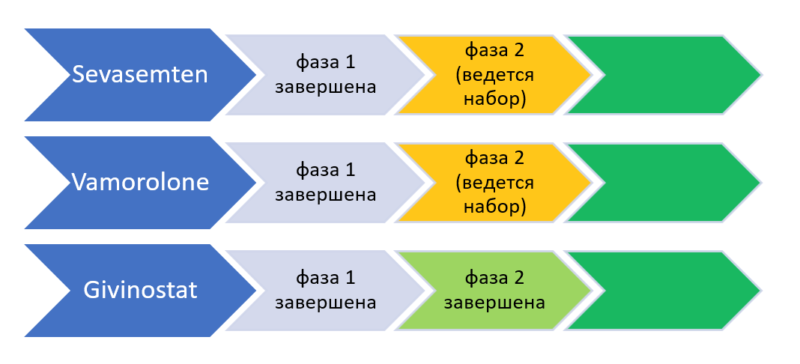
Да, в отношении двух препаратов (Vamorolone и Sevasemten) в США и Великобритании ведется набор пациентов с мышечной дистрофией Беккера в целях проведения второй фазы испытаний. По третьему препарату (Givinostat) 19.03.2021 завершена вторая фаза и опубликованы результаты. Подробнее в нашей публикации и пайплайне.
EDG-5506/Sevasemten (испытание — GRAND CANYON)
Спонсор: Edgewise Therapeutics, Inc
Дата начала исследования: 06.07.2022
Предполагаемая дата завершения исследования: июнь 2026
Требуемое количество участников: 170 человек (возраст от 12 до 50 лет)
Контактные данные:
тел. 720-262-7002
email: studies@edgewisetx.com
Vamorolone
Спонсор: ReveraGen BioPharma, Inc.
Дата начала исследования: 07.07.2022
Предполагаемая дата завершения исследования: 30.06.2025
Требуемое количество участников: 39 человек (возраст 18 до 64 лет)
Контактные данные:
Eric P Hoffman, Ph.D.
301-762-7980
Источник: Study Details | A Study to Assess Vamorolone in Becker Muscular Dystrophy (BMD) | ClinicalTrials.gov
Givinostat
Спонсор: Italfarmaco
Дата начала исследования: 12.12.2017
Дата завершения исследования: 19.03.2021
Результаты:
Из 51 пациента, принявшего участие в испытании, 44 завершили лечение. На исходном уровне в плацебо-группе наблюдалось больше проявлений заболевания, чем у группы, принимавшей Гивиностат [далее- контрольная группа]. Согласно показателям общего фиброза и функциональных конечных точек в среднем у плацебо-группы объем замещения мышц соединительной тканью составил в среднем 30,8 %, тогда как у контрольной группы 22,8%.
Средний общий фиброз [замещение соединительной тканью] не изменился по сравнению с исходным уровнем ни в одной из групп, показатели по двум группам не различались на 12-м месяце [испытания, общий срок проведения испытания составил 3 года и 8 месяцев]. Вторичные гистологические параметры [биопсия], MRS [5-бальная шкала мышечной силы] и функциональные оценки соответствовали первичным. При выполнении МРТ мышц, было установлено, что жировая фракция в бедре и четырехглавой мышце не изменялась по сравнению с исходным уровнем в контрольной группе, но значения увеличивались при приеме плацебо, при этом различия между Гивиностатом и плацебо составляли 1,35% (p = 0,0149) и 1,96% (p = 0,0022) соответственно. Нежелательные явления, наиболее легкие или умеренные, отмечались у 88,2% и у 52,9% пациентов, получавших Гивиностат и плацебо.
Важная оговорка
Данная статья не является призывом к участию граждан России в испытаниях лекарственных препаратов за рубежом. Мы понимаем, что участие в таких клинических испытаниях очень серьезная инициатива, требующая множества согласований и сопряженная с большим количеством рисков.
Публикация показывает, что для мышечной дистрофии Беккера, разрабатывается лечение, которое предположительно, может стать доступным ориентировочно в 2026-2027 гг. К тому же, такое количество времени необходимо, чтобы мы могли с вами понять, будут ли данные виды лечения безопасными в долгосрочной перспективе.
Материал подготовлен: Бережной Е.Н. и Бережным Д.С.
