Экспериментальная пероральная терапия EDG-5506 является безопасной. Ее применение приводит к выраженному и быстрому снижению уровня мышечных повреждений согласно биомаркерам пациентов с Мышечной дистрофией Беккера (МДБ).
«Мы считаем, что уровень снижения мышечных повреждений по множеству ключевых биомаркеров у взрослых с МДБ спустя только через две недели приема, беспрецедентна” сказал Kevin Koch», — президент Edgewise Therapeutics, разработчика терапии.
“Мы ожидаем, что лечение препаратом EDG-5506 снизит уровень повреждения мышц — главной причины дистрофинопатий. В конечном итоге это приведет к улучшению [двигательной] функции у людей с Дюшенном и Беккером.” — дополнил свою реплику Koch.
Дистрофинопатии относятся к нервно-мышечным заболеваниям, вызванным мутациями в гене DMD и включают в себя МДД и МДБ, более мягкую форму. Ген DMD обеспечивает организм инструкциями для выработки дистрофина [белка]. Этот белок помогает защищать мышечные клетки от получения повреждений, в момент когда человек включает мышцы. Например, при ходьбе или выполнении каких-либо движений.
О результатах первой фазы испытаний
Недавно компания провела вебтрансляцию, в рамках которой обсуждались результаты первой фазы испытаний (б). Edgewise планирует запустить вторую фазу испытаний у взрослых пациентов взрослых с МДБ в ближайшие месяцы. При этом, вторую фазу испытаний препарата с участием детей с МДД компания планирует провести во второй половине этого года.
“Мы рады объявить, что на данный момент идет набор пациентов для предстоящего открытого исследования (ARCH). Мы приятно удивлены положительными отзывами от имени пациентов. А именно, тех кто уже принял участие в испытаниях и новых участников.” — Joanne Donovan, доктор медицинских наук, директор по медицине в Edgewise.
Испытание ARCH (NCT05160415) оценит уровень безопасности приема препарата EDG-5506 в дозировке 10 мг. Срок проведения три месяца. Будет проверена его фармакокинетика*, влияние на биомаркеры мышечных повреждений у 7 пациентов с МДБ. Речь идет о пациентах, завершивших свое участие в первой фазе испытаний (б) (NCT04585464).
Еще один мужчина с МДБ примет участие в испытаниях через Исследовательский центр редких заболеваний в Атланте.
Механизм действия EDG-5506
EDG-5506 является пероральной малой молекулой, действие которой направлено на основополагающую причину мышечной дистрофии. Данный препарат, в частности, останавливает повреждение мышечных волокон и образование рубцовой ткани, которые приводят к мышечной слабости и истощению.
Говоря конкретно, он работает путем подавления действия миозина, белка, вовлеченного в процесс мышечных сокращений. Этот белок в свою очередь находится в мышечных волокнах, подверженных повреждению. И наконец эти повреждения возникают вследствие сокращения мышц. При МДБ и МДД все это происходит из-за дефицита дистрофина.
Что такое миозин?
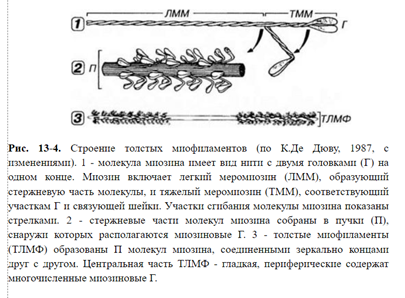
Молекулы этого белка образуют миофиламенты — толстые нити в составе сократительного аппарата мышечного волокна. Молекула миозина имеет вид нити. На одном из концов эта молекула содержит 2 округлые головки. Ферментами миозин расщепляется на 2 фракции — легкий меромиозин (“стержень” молекулы) и тяжелый меромиозин (участки головок и шейки, связывающей их со стержневой частью). Молекула миозина может сгибаться, как на шарнирах, в месте соединения тяжелого меромиозина с легким и в области прикрепления головки.
EDG-5506 избирательно ограничивает повреждения восприимчивых мышечных волокон до уровня, достаточного для предотвращения разрушения мышц. При этом, препарат сохраняет мышечную функцию у широкого круга пациентов с редкими нервно-мышечными расстройствами, согласно заявлениям Edgewise.
Ранее мы писали, что терапия получила статус ускоренного рассмотрения в США в качестве лечения для МДБ, это обозначение подразумевает ускоренный процесс рассмотрения регуляторами.
Обнадеживающие результаты на животной модели (собак и мышей) с мышечной дистрофией подтолкнули к запуску первой фазы испытаний с участием человека. Их основная цель заключается в оценке безопасности, переносимости и фармакологических качеств.
Часть первой фазы испытаний ставит своей целью проверку разовой и многократно нарастающей дозировки препарата в сравнении с плацебо. Участие приняли здоровые взрослые волонтеры в целях определения оптимальной дозировки препарата. Во второй части Фазы 1b 7 мужчинам с МДБ ежедневно в случайном порядке назначали препарат в дозировке 20 мг или плацебо в течение 14 дней подряд. Пятеро участников испытания получали препарат в твердой лекарственной форме, а двое получали плацебо.
О безопасности препарата EDG-5506
Недавно опубликованные результаты Фазы 1 b показали, что EDG-5506 в целом хорошо переносится и не имеет серьезных побочных эффектов, которые могут повлечь прекращение лечения или снижение дозировок. Побочные эффекты были умеренными, временными и похожими среди обследованных здоровых волонтеров.
Самым распространенным побочным эффектом, обнаруженным у 7 мужчин, было головокружение, которое исчезало без необходимости медицинского вмешательства.
Подобно наблюдениям за здоровыми добровольцами, экспериментальная терапия не влияла на силу хвата рук, плеч или бедренных мышц пациентов.
Лечение EDG-5506 также привело к воздействию на кровь и мышцы, в целом соответствующему тому, что наблюдалось у здоровых добровольцев. Воздействие на мышцы превысило уровни, которые определяют значимый клинический эффект. Это подчеркивает уверенное целевое взаимодействие, согласующееся с сильным связыванием EDG-5506 с миозином в целевых мышечных волокнах.
Кроме того, EDG-5506 приводит к значительному в зависимости от времени снижению уровней ключевых биомаркеров мышечных повреждений. Это близко к диапазону нормальных значений. Креатинфосфокиназа (КФК) и тропонин являются наиболее чувствительными к лечению EDG-5506. Их показатели снизились на 71-83%, что стало ближе к уровню здоровых волонтеров.
Дальнейший анализ показал, что увеличенные уровни биомаркеров у пациентов с МДБ относительно здоровых людей в начале испытания коррелировали с уверенными снижениями (биомаркеров) в процессе лечения. Это свидетельствует о широкой нормализации молекулярной характеристики МДБ.
“Уверенное снижение биомаркеров мышечных повреждений, обнаруженное у пациентов с МДБ, подтверждает, что EDG-5506 может нормализовать выраженную нагрузку на дистрофическую мышцу. Это, в конечном итоге, сохранит мышечную функцию и предотвратит прогрессию заболевания”, — из трансляции Edgewise.
Крейг МакДональд, профессор и заведующий кафедрой медицины и реабилитации Калифорнийского университета в Дэвисе, рад результатам.
«Меня воодушевили клинические данные EDG-5506 в фазе испытаний 1b. Ведь для пациентов с МДБ отсутствует лечение».
О дальнейшей работе
“Я готов к работе с нашими коллегами разработчиками и сообществом пациентов с МДД и МДБ в предстоящей второй фазе испытаний EDG-5506”, — добавил он.
Кроме того, Edgewise планирует запустить испытание по естественной истории МДБ в ближайшие месяцы. Целью испытания является оценка естественного течения болезни. Информация такого рода — ключ к лучшему пониманию заболевания. Результаты испытания помогут лучше определить показатели, используемые в клинических испытаниях экспериментальных методов лечения.
Эти “наблюдательные” испытания могут также служить в качестве внешних “регуляторов” инвазивных клинических испытаний.
*Фармакокинетика объясняет движение лекарства внутри организма.
Источник: musculardystrophynews.com
Перевод выполнен: Бережной Д.С.
В подготовке статьи приняли участие: Бережная Е.Н.
