Что такое Мышечная дистрофия Беккера?
Мышечная дистрофия Беккера (далее также — МДБ) одна из мышечных дистрофий, группы генетических дегенеративных заболеваний, преимущественно поражающих скелетные мышцы. Болезнь получила свое название после того, как доктор Петер Эмиль Беккер впервые описал такой вариант мышечной дистрофии Дюшенна (далее также -МДД) в пятидесятые годы XX века. МДБ аналогична МДД, но только позволяет мышцам функционировать лучше, чем в случае с МДД. Сердечная мышца, тем не менее, может быть повреждена таким же образом, как и при МДД.
К представленному ниже видеоматериалу силами МОО «Проект Ай-Мио» подготовлены субтитры на русском языке. Чтобы их подключить откройте настройки -> субтитры -> русский язык.
Каковы симптомы Мышечной дистрофии Беккера?
МДБ обычно проявляется в позднем детстве либо в подростковом возрасте, ее течение более медленное и менее предсказуемое, чем при МДД. Слабость распространяется в первую очередь на мышцы бедер, тазовой области, плеч. Икры зачастую увеличены. Возможно значительное вовлечение сердечной мускулатуры. Для более подробной информации смотрите раздел «Симптомы».
Какова причина Мышечной дистрофии Беккера?
До восьмидесятых годов XX века было недостаточно информации о причинах возникновения тех или иных мышечных дистрофий. В 1986 был идентифицирован ген, повреждаемый в результате мутации, что приводит к мышечной дистрофии Дюшенна или Беккера. Через год Луисом М. Кункелем был открыт белок, связанный с этим геном, и ему дали название «Дистрофин».
Было доказано, что дефицит дистрофина является одной из основных причин заболевания, известного как мышечная дистрофия.
В нормальной ткани скелетной мышцы содержится небольшое количество дистрофина (около 0,002% от основной массы белка мышцы), но его отсутствие или изменение приводит к развитию тяжелой и практически неизлечимой болезни — мышечной дистрофии, в процессе которой наблюдается некроз мышечных волокон, а также прогрессирующая мышечная слабость и утомляемость, что может приводить к инвалидности и даже летальному исходу.
В то время как мутации при МДД по сути приводят к невозможности выработки дистрофина, люди с МДБ могут вырабатывать его частично функционирующим. Они могут производить его укороченную версию, которая защищает мышцы людей с МДБ от полного разрушения как при МДД.
МДБ преимущественно поражает мужчин, которые наследуют болезнь от матери. Женщины могут быть носителями, или их заболевание будет протекать бессимптомно. Для более подробной информации о том, как генные мутации вызывают МДБ, смотрите раздел «Причины/Наследственность».
Какова продолжительность жизни при мышечной дистрофии Беккера?
Большинство людей с МДБ способны дожить до зрелого возраста и дальше. Более подробно о жизни с МДБ, смотрите раздел «Медицинский уход». Если сердечные заболевания минимальны, или если они разумно контролируются посредством медицинского вмешательства, нормальная или близкая к нормальной продолжительности жизнь вполне ожидаема.
Какой статус исследований по МДБ?
Исследователи преследуют несколько стратегий для лечения МДБ. Среди главенствующих стратегий замена гена; генное редактирование (CRISPR/Cas9), стволовые клетки, ингибирование белка миостатина, увеличение уровня белка утрофина; применение усовершенствованных стероидов для снижения воспаления мышечных волокон . Подробнее смотрите раздел «Исследования».
Признаки и симптомы
Паттерн («рисунок») утраты мышц при Мышечной дистрофии Беккера (МДБ) обычно начинается с тазобедренной области, бедер и плеч. Для компенсации работы ослабших мышц человек может ходить «вразвалочку» (по утиному) или на “носочках”, либо с выставленным вперед животом.
МДБ медленно приводит к инвалидности вследствие снижения подвижности и способности самостоятельного ухода. Это может выражаться в сердечных проявлениях, таких как: учащенное сердцебиение, головокружение, обморок, одышка в состоянии покоя или во время физической нагрузки.
При этом, уровень мышечной дегенерации очень сильно отличается в зависимости от пациента. Некоторым мужчинам требуются кресла-коляски к тридцати годам или позже, в то время как другие справляются при помощи небольших приспособлений, таких как трость.
Болевые ощущения и органы чувств
МДБ не оказывает прямого воздействия на нервы. Органы чувств остаются в норме, в равной степени как и контроль над непроизвольными мышцами мочевого пузыря и кишечника, а также половой функцией.
Изнашивание мышц при МДБ обычно само по себе не является болезненным. Некоторые пациенты сообщают время от времени о коликах (крампи), которые могут быть сняты безрецептурными обезболивающими.
Сердце
Как и мышцы конечностей, сердечные мышцы также могут быть ослаблены из за отсутствия дистрофина. У людей с МДБ часто развивается кардиомиопатия — слабость сердечной мышцы — вызванная нехваткой дистрофина. Мышечной слой (миокард) сердца истощается, также как это происходит со скелетными мышцами.
Вред наносимый МДБ сердцу может стать жизнеугрожающим еще в подростковом возрасте. Некоторые пациенты с МДБ имеют менее выраженное вовлечение скелетной мускулатуры, но более серьезные проблемы с сердцем. По этим причинам каждый пациент с МДБ должен наблюдаться у кардиолога. Смотрите секцию медицинского ухода для дополнительной информации по ведению проблем с сердцем.
Также к просмотру предлагается презентация кардиолога Elizabeth McNally «Осложнения сердца и лечение при МДБ, август 2012».
Дыхание и откашливание
Дыхательная мускулатура при МДБ сохраняется сильной много лет, но в конечном итоге, она становится слабее для поддержания оптимального дыхания и откашливания (для очистки дыхательных путей от выделений)
Смотрите выступление пульмонолога, видеоматериал от августа 2012 — “Здоровье легких при нервно-мышечных заболеваниях”.
Обучение
Врачи считают, что отклонения в работе головного мозга из-за дистрофина могут приводить к едва уловимым познавательным и поведенческим отклонениям. Проблемы с обучением, обнаруженные у некоторых пациентов с МДБ, происходят в трех основных областях: сосредоточенность и внимание, устное изучение и память, эмоциональное взаимодействие.
Для дополнительной информации как справляться с умственными дефектами, смотрите раздел «медицинский уход».
Источники:
- Bradley, W. G., Jones, M. Z., Mussini, J. -M & Fawcett, P. R. W. Becker-type muscular dystrophy. Muscle Nerve (1978). doi:10.1002/mus.880010204
- Ho, R., Nguyen, M.-L. & Mather, P. Cardiomyopathy in becker muscular dystrophy: Overview. World J. Cardiol. (2016). doi:10.4330/wjc.v8.i6.356
- Ruiz-Cano, M. J. et al. Successful heart transplantation in patients with inherited myopathies associated with end-stage cardiomyopathy. Transplant. Proc. (2003). doi:10.1016/S0041-1345(03)00515-3
- Melacini, P. et al. Myocardial involvement is very frequent among patients affected with subclinical Becker’s muscular dystrophy. Circulation (1996). doi:10.1161/01.CIR.94.12.3168
- Yazawa, M. et al. A family of becker’s progressive muscular dystrophy with severe cardiomyopathy. Eur. Neurol. (1987). doi:10.1159/000116122
- Ricotti, V. et al. Neurodevelopmental, emotional, and behavioural problems in Duchenne muscular dystrophy in relation to underlying dystrophin gene mutations. Dev. Med. Child Neurol. (2016). doi:10.1111/dmcn.12922
- Bushby, K. M. D. & Gardner-Medwin, D. The clinical, genetic and dystrophin characteristics of Becker muscular dystrophy — I. Natural history. J. Neurol. (1993). doi:10.1007/BF00858725
- Daoud, F. et al. Analysis of Dp71 contribution in the severity of mental retardation through comparison of Duchenne and Becker patients differing by mutation consequences on Dp71 expression. Hum. Mol. Genet. (2009). doi:10.1093/hmg/ddp320
Причина мышечной дистрофии Беккера
Мышцы состоят из пучков волокон (клеток). Группа взаимозависимых белков вдоль мембраны, окружающих каждое волокно, помогает поддерживать работоспособность мышечных клеток. Отсутствие одного из таких белков (в данном случае дистрофина) приводит к Мышечной дистрофии Дюшенна (далее — МДД). Малое или недостаточное количество дистрофина приводит к Мышечной дистрофии Беккера (далее-МДБ).
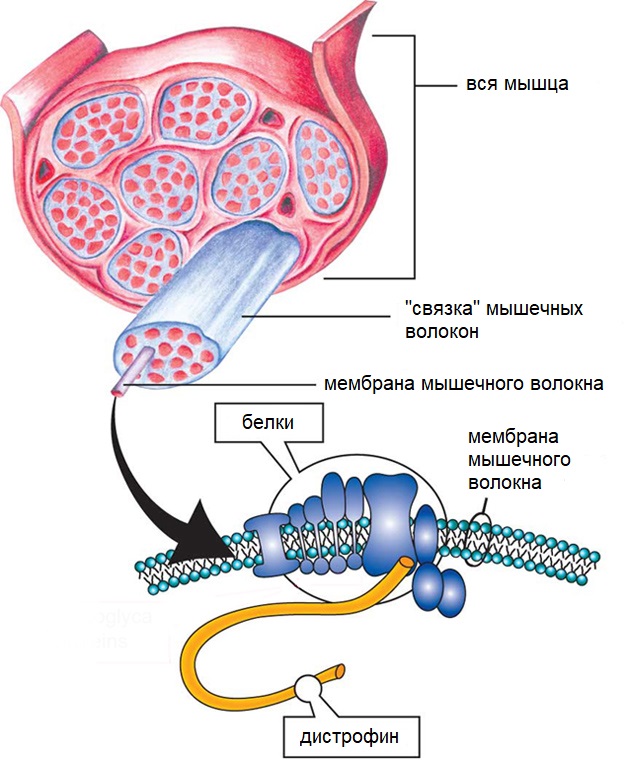
В 1986 был идентифицирован ген, повреждаемый в результате мутации, и вызывающий мышечную дистрофию Дюшенна или Беккера. В 1987 был идентифицирован белок кодируемый этим геном — ему дали название Дистрофин.
Гены содержат инструкции для белков, являющихся важнейшим биологическим компонентом для всех форм жизни. МДБ возникает когда белок дистрофин, производимый одноименным геном на X — хромосоме, функционирует лишь отчасти. Дистрофин играет роль в поддержании целостности мышечных клеток. Отсутствие выработки дистрофина приводит к тому, что клетки становятся хрупкими и могут легко повреждаться.
При МДБ дистрофин производится в укороченном виде и функционирует только отчасти. Мышцы при МДБ не разрушаются настолько быстро, как в случае с МДД, где функциональный дистрофин практически отсутствует.
Наследственность при мышечной дистрофии Беккера
Сбитые с толку родители часто спрашивают, ”Но в семье этим никто не болел, так как же это заболевание может быть генетическим?”.
МДБ может присутствовать в семье, даже если один из членов биологической семьи имеет ее. Все потому что генетические заболевания наследуются по разному.
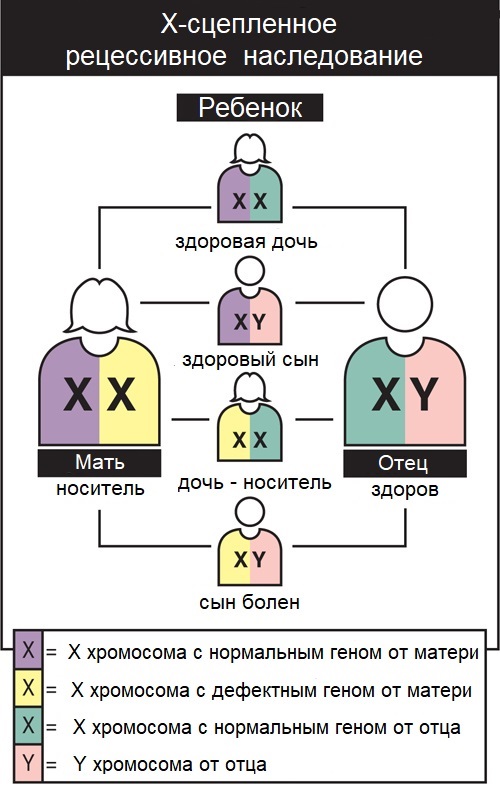
МДБ наследуется по X-сцепленному механизму наследования. Это означает, что ген, который может содержать мутацию, вызывающую те или иные заболевания, находится на X-хромосоме.
Каждый мальчик наследует X-хромосому от матери, а Y-хромосому от отца, что обуславливает пол ребенка. Девочки получают две X-хромосомы, по одной от каждого родителя. Каждый сын, родившийся от женщины с мутацией дистрофина в одной из двух ее Х-хромосом, имеет 50-процентную вероятность наследования дефектного гена и наличия МДБ. Каждая из ее дочерей имеет 50 процентную вероятность наследования мутации будучи ее носителем.
Носители обычно не имеют симптомов болезни, но могут иметь болеющего ребенка или носителя мутации. Носители МДБ имеют риск развития кардиомиопатии (см. Признаки и симптомы).
Как может в семье без наличия в истории болезни МДБ родиться ребенок с таким заболеванием?
Есть два возможных объяснения:
- Генетическая мутация приводящая к МДБ может существовать у женщин в одной семье в нескольких поколениях и никто не будет знать об этом. Вероятно, что у семьи не родится мальчик с болезнью, или, даже если в ранних поколениях рождался мальчик с такой болезнью, близкие могли и не знать чем он болен.
- Другая возможность заключается в том, что ребенок с МДБ имеет новую мутацию, возникшую в одной из яйцеклеток матери. (Поскольку эта мутация отсутствует в клетках крови матери, ее невозможно обнаружить с помощью стандартного тестирования носителей болезни).
Болезни наследуемые по x-сцепленному рецессивному признаку в основном поражают мужчин, потому что вторая X-хромосома защищает женщин от проявлений симптомов.
Если мать рожает ребенка с МДД, всегда есть вероятность, что более чем одна яйцеклетка имеет мутацию в гене дистрофине. Появляется риск (выше среднего значения) передачи мутации другому ребенку.
Мужчина не может передать дефектный ген своим сыновьям, потому что он дает сыну Y-хромосому, не X-хромосому. Но он определенно передаст этот ген своим дочерям, потому что каждая дочь наследует от отца только X-хромосому. Тогда дочери станут носителями, а каждый из сыновей будет иметь 50% вероятность развития заболевания. Хороший способ узнать больше о механизме наследования МДБ в семье — это обратиться к специалисту.
Для большей информации смотрите буклет MDA факты о генетике и НМЗ и видеоматериал 2012 года Генетика МДБ: «Почему Ваша мутация имеет значение?» (чтобы посмотреть видеоматериал на русском языке — нажимаем на значок “шестеренка” — субтитры — “перевести” — выбираем “русский язык”)
Девушки и МДБ
Почему девушки обычно не болеют МДБ? Когда девушка наследует дефектный ген от одного родителя, она обычно получает здоровый ген дистрофин от другого родителя, дающего ей достаточное количество белка дистрофина, чтобы защитить ее от проявлений болезни. Мужчины, которые наследуют мутацию, заболевают, потому что у них нет второго исправного гена дистрофина, который мог бы восполнить неисправный.
Тем не менее, хоть девушки обычно и не получают всех проявлений МДБ, некоторые из них с дефектным геном в определенной степени оказываются затронутыми этой болезнью. Меньшая часть женщин с мутацией являются носителями, которые обычно при этом имеют легкую форму заболевания.
Для этих женщин, дефицит дистрофина может быть причиной слабости и быстрой утомляемости мышц спины, рук и ног. Некоторым из пациенток даже может понадобиться кресло-коляска либо помощь в передвижении. Носители могут иметь проблемы с сердцем, которые приводят к затруднению дыхания и невозможности выполнять обычные физические упражнения. Проблемы с сердцем, при отсутствии лечения, могут быть достаточно серьезными, даже жизнеугрожающими.
Женщина, приходящаяся родственником кому-либо с МДБ, может рассчитывать на полный спектр диагностических тестов для определения ее статуса, в качестве носителя. В случае если она окажется носителем, регулярные замеры силы и тщательные обследования сердца могут помочь справиться с симптомами, которые могут возникнуть.
Медицинский уход
Благодаря общим медицинским рекомендациям, в частности в области кардиологии, люди с Мышечной дистрофией Беккера (МДБ) в 21 веке живут дольше, чем в предыдущие десятилетия. По состоянию на 2019 год, лечение в основном симптоматическое, при этом активно ведутся исследования в целях разработки терапии, направленной на причину заболевания.
Применение доступных видов терапии может помочь обеспечить продолжительную и комфортную жизнь.
Предлагается к просмотру презентация по медицинскому уходу при МДБ с участием детского невролога, из материалов Конференции, посвященной МДБ 2012.
Анестезия
Люди с МДБ могут иметь непредвиденные побочные реакции к определенным типам анестезии. Команде врачей проводящей хирургическое вмешательство очень важно знать, что у пациента МДБ, чтобы осложнения не были проигнорированы и были незамедлительно устранены.
Ортезы и кресла-коляски
Ортезы могут поддерживать только лодыжку и стопу, захватывая также колено. Ортезы на голеностопные суставы иногда назначают для ночного ношения, чтобы стопы не свисали вниз и не растягивали ахиллово сухожилие.
Смотрите презентацию по данной теме: Особенности функционального лечения: ортопедия.
Некоторым людям с МДБ в конечном итоге требуется кресло-коляска. Хотя некоторые из этих приспособлений символизируют инвалидность, большинство пользователей считают себя на самом деле более мобильными, активными и независимыми, когда используют кресло-коляску вместо того, чтобы пытаться ходить на довольно ослабленных ногах. Кресла-коляски (с приводом) особенно полезны для преодоления больших дистанций.
Смотрите презентацию реабилитолога — видеоматериал за август 2012 года.
Уход за сердцем
Кардиомиопатия, которая подразумевает разрушение сердечной мышцы, достаточно распространена при МДБ. Например, Американская академия педиатрии рекомендует людям с МДБ проводить диагностику сердца не реже одного раза в год начиная с десяти лет.
У носителей МДБ риск развития кардиомиопатии оценивается от ниже среднего до довольно высокого. Специалисты рекомендуют чтобы носители подвергались проведению комплексной оценки состояния сердечной мышцы в позднем подростковом возрасте и раннем зрелом возрасте, и дальше если симптомы будут проявляться.
Некоторые люди с МДБ и кардиомиопатией, имеющие в целом хорошее здоровье, были успешно вылечены (от кардиомиопатии)с помощью трансплантации сердца.
Осложнения и лечение сердечно-сосудистых заболеваний (видео презентация 2012 года о помощи при проблемах с сердцем).
Контрактуры
Когда мышца истощается, у человека с мышечной дистрофией часто развивается фиксация суставов, известная как контрактура. Если контрактуры не исправлять, то они могут быть более сильными, доставляя дискомфорт и ограничивая мобильность и гибкость. Воздействие МДБ можно существенно минимизировать поддерживая гибкость тела, находясь в положении стоя и будучи по возможности мобильным.
Есть несколько способов для уменьшения и замедления развития контрактур. Упражнения на диапазон движений (растяжки)*, выполняемые регулярно по расписанию (графику), помогают задержать развитие контрактур, предотвращая преждевременное сокращение сухожилий. Важно, чтобы Ваш физиотерапевт (ЛФК-тренер) показал Вам как правильно делать такие упражнения.
Ортезы на нижних конечностях помогают держать конечности вытянутыми и гибкими, задерживая начало проявления контрактур.
Когда контрактуры развились, может быть проведено хирургическое вмешательство чтобы их смягчить. Процедура по высвобождению сухожилия, также называемая операцией «пяточного шнура», может помочь в лечении контрактур в области лодыжки ( и др. контрактур).
Диета и питание
В отношении приема пищи нет каких-либо особых ограничений или предписаний для МДБ. Большинство врачей советуют придерживаться диеты аналогично той, что назначают растущему ребенку, но с учетом некоторых изменений.
Комбинация с ограниченными возможностями к передвижению и слабыми брюшными мышцами может привести к сильным запорам, так что диета в таком случае должна быть обогащена высоким содержанием жидкости и пищевых волокон, преимущественно свежими фруктами и овощами.
Для мальчиков и мужчин использующих кресла-коляски на приводе, и тех кто не очень активен или принимает преднизолон возможен набор лишнего веса. Для снижения веса потребление калорий должно быть ограничено, ведь ожирение создает большую нагрузку на без того ослабленные скелетные мышцы и сердце.
Тем пациентам, кто принимает преднизолон и кому диагностирована кардиомиопатия может потребоваться безуглеводная диета.
Смотрите также: «Потребности в питании при нервно-мышечных заболеваниях» Презентация с видео-конференции, посвященной мышечной дистрофии Беккера (август 2012)
Физические упражнения
Упражнения могут помочь в построении скелетных мышц, поддержании здоровья сердечно-сосудистой системы и способствовать хорошему самочувствию. Но при мышечной дистрофии интенсивные упражнения могут только навредить мышцам. Проконсультируйтесь со своим лечащим врачом (реабилитологом, ЛФК -тренером) о том какие упражнения Вам могут подойти лучше всего. Человек имеющий МДБ может выполнять упражнения умеренно, но не допуская утомления.
Некоторые специалисты рекомендуют плавание или водные упражнения (акватерапию) в качестве хорошего способа поддержания тонуса мышц, насколько это возможно, и при этом не вызывая в них чрезмерного напряжения. Применение средств для удержания на воде помогает защититься от определенного рода мышечного переутомления.
Перед тем, как принять участие в каких либо программах упражнений, удостоверьтесь что у Вас есть возможность проводить регулярную оценку состояния сердца.
Проблемы с обучением
Нехватка дистрофина может приводить к проблемам в познавательной деятельности у некоторых людей. Детям и взрослым с МДБ у которых были замечены проблемы с обучением необходимо наблюдаться у нейропсихолога.
Если диагностированы проблемы с образовательным процессом, образовательные и психологические вмешательства можно начинать незамедлительно. Специалист может расписать упражнения и техники, которые помогут устранить упомянутые недостатки, в школах может быть оказана специальная помощь в обучении.
Лекарства
Препараты, которые снижают нагрузку на сердце, иногда назначают при МДБ. Есть некоторые свидетельства, что лечение ингибиторами ангиотензинпревращающего фермента (АПФ) и бета-блокерами может замедлить изнашивание сердечной мышцы при МДБ.
Если эти лекарства как только появятся отклонения от нормы на эхокардиограмме, но до начала симптомов.
Препараты группы кортикостероидов (преднизолон, дефлазакорт) считаются эффективными в замедлении течения мышечной дистрофии Беккера. Информация о минусах и плюсах использования кортикостероидов при МДБ на данный момент отсутствует. Тем не менее некоторые врачи назначают кортикостероиды для лечения МДБ при тяжелых его проявлениях. Аналогично, как это делается в случае с МДД, лечение назначается с согласия пациента либо его семьи.
Преднизолон (дефлазакорт, deflazacort) вне всякого сомнения самый распространенный назначаемый кортикостероид для МДД и МДБ во многих странах (Россия, США, страны Европы и др.). Если говорить об относительно высоких дозах на долгие периоды времени, то это может привести к выраженным проявлениям побочных эффектов, таких как набор веса, сниженная плотность костей, поведенческие отклонения, катаракта и торможение роста.
Физиотерапия, реабилитация и трудотерапия
Программа физиотерапии является обычной составляющей лечения МДБ. Ваш лечащий врач может направить Вас к физиотерапевту для тщательной оценки состояния и рекомендаций.
Основные цели физиотерапии улучшить подвижность в суставах, предотвратить контрактуры и сколиоз (искривление позвоночника). Реабилитация сосредоточена на определенных видах активности, таких как решение задач, активный отдых и развлечения, вождение, рукоделие или использование компьютера.
Видеоматериал по данной теме, Функциональные решения: трудо и физиотерапия.
Респираторная (дыхательная) поддержка
У некоторых людей с МДБ, с возрастом, дыхательная мускулатура может ослабевать, приводя к неоптимальному дыханию, а именно во время сна. Это лечится посредством неинвазивной стратегии известной как “двухуровневое положительное давление в дыхательных путях”. Мышцы сокращающиеся во время кашля также могут стать слабыми, позволяя наращивать количество мокроты в дыхательных путях, все это может привести к обструкции и инфекции. Устройство «откашливатель» поможет решить эту проблему.
Смотрите презентацию с участием пульмонолога. Видео Август 2012 года.
* Диапазон движения: полный потенциал движения сустава, обычно его диапазон сгибания и разгибания. Например, колено может не иметь 10 градусов полного разгибания из-за травмы, либо контрактуры.
Источник: Ассоциация Мышечных Дистрофий (MDA)
Перевод: Бережной Д.С.
Диагноз
Диагноз “Мышечная дистрофия Беккера” (далее — МДБ) может быть поставлен в детстве, как правило после 7 лет. Иногда, тем не менее, он не может быть поставлен в подростковом и даже зрелом возрасте. Диагностика становится необходимой, например, когда юноша осознает, что не может продолжать занятия по физической культуре или не может пройти военную подготовку.
Постановка диагноза любой формы мышечной дистрофии обычно начинается с изучения истории заболевания пациента и его семьи, и медицинского осмотра. Полученные данные объясняют механизм проявления мышечной слабости. История заболевания и текущее физическое состояние имеют большое значение для постановки диагноза, даже до того, как будут выполнены какие-либо сложные диагностические тесты.
Врач также стремится определить, была ли мышечная слабость пациента вызвана проблемой в самих мышцах или нервах, контролирующих мышцы. Проблемы в нервах, контролирующих мышцы, или двигательных нейронах (простирающихся от спинного и головного мозга и достигающих всех мышц), могут вызвать слабость, которая будет выглядеть как проблема с мышцами, но на самом деле это не так.
В связи с тем, что другие заболевания имеют некоторые похожие на МДБ симптомы, возможно ошибочное диагностирование мышечной дистрофии Дюшенна (МДД) или поясно-конечностной мышечной дистрофии (ПКМД) вместо МДБ. Именно по этой причине важно пройти через процесс тщательной диагностики, включая генетический тест, прежде чем предполагать, что это МДБ.
Уровень креатин-киназы (CK)
В начале диагностических процедур врачи часто назначают специальный анализ крови, который определяет уровень креатин-киназы (далее — CK) — энзима, утечка которого происходит из поврежденной мышцы. Когда в крови обнаруживаются повышенные уровни CK, это обычно означает, что мышца разрушается из-за патологического процесса. Следовательно, высокий уровень CK говорит о том, что сами мышцы являются вероятной причиной слабости, но он не говорит точно, каким может быть мышечное расстройство. При МДБ уровни CK у мужчин обычно превышают нормальные уровни — до пяти раз выше верхнего предела нормальных значений или более. У женщин-носителей уровень CK может превышать норму от 2 до 10 раз.
Генетическая диагностика
ДНК-анализ гена дистрофина для диагностирования МДБ на данный момент становится более доступным и выполняется, обычно, посредством забора крови. В большинстве случаев, только ДНК-тест с достаточно высокой степенью достоверности может рассказать семьям и врачам, какое течение заболевания является более вероятным: МДБ или МДД.
Родственницы мужчин и мальчиков с МДБ могут пройти ДНК-тестирование чтобы определить являются ли они носителями болезни. Если да, то они могут родить детей, которые сами станут носителями заболевания либо у них будет развиваться МДБ.
Предлагается к просмотру презентация специалиста по генетике, «Генетика МДБ: Почему Ваша мутация имеет значение».
В некоторых случаях, для бо́льшей определенности в заболевании и его течении, врач назначает биопсию мышц, при которой берут небольшой образец мышечной ткани для специального обследования. Мышечная биопсия может быть проведена в рамках научного исследования.
Источник: Ассоциация мышечных дистрофий (MDA)
Перевод: Бережной Д. С.
Исследования
Некоторые из передовых стратегий включают в себя: введение гена дистрофина; изменение способов интерпретации клетками генных инструкций дистрофина; исправление самого гена; управление другими белками организма для компенсации отсутствия/нехватки дистрофина; совершенствование стероидных препаратов, и использование стволовых клеток для восстановления поврежденных мышц1.
Другие исследования сосредоточены на лечении сердечной недостаточности, связанной с недостатком дистрофина.
Повреждения гена дистрофина приводят к мышечной дистрофии Дюшенна (МДД), таким же образом, как и при менее тяжелой форме — мышечной дистрофии Беккера (МДБ). Множество стратегий лечения, опробованных при МДД, применимы для мышечной дистрофии Беккера.
Чтобы узнать больше информации об исследованиях, посвященных МДБ, предлагаем ознакомиться с данными видеоматериалами: Доклинические исследования мышечной дистрофии на животных моделях и МДБ: От целей до клинических испытаний.
Кардиологическая поддержка
Исследователи преследуют несколько стратегий для поддержки и улучшения сердечной функции при МДБ и МДД. Они в основном тестируют существующие препараты на предмет возможной пользы для пораженного при МДД и МДБ сердца и проводят исследования с целью понять и найти новые подходы в лечении сердца при таких заболеваниях.
В 2009 году исследователи выяснили, что мутации в гене дистрофине, вызывающие кардимиопатию при МДБ, могут не поражать регионы белка, отвечающие за потерю скелетных мышц. Исследования могут позволить лучше прогнозировать появление кардиомиопатии при МДБ и применять кардиопротекторную терапию на более ранних этапах. Также они дают исследователям представление о том, какие части белка необходимо сохранить при рассмотрении укороченных молекул дистрофина в качестве терапевтических стратегий.
Обнаружено, что лекарственное средство силденафил (виагра) оказывает кардиопротекторный эффект на мышей с заболеванием, подобным МДД, как на ранней, так и на поздней стадии. Силденафил, используемый для лечения эректильной дисфункции, принадлежит к классу ингибиторов фосфодиэстеразы-5 (ФДЭ5). Он расслабляет гладкую мускулатуру, выстилающую кровеносные сосуды, увеличивая приток крови к мышцам и сердцу. Кардиальные эффекты силденафила у подростков и мужчин с МДД изучаются.
Лабораторные исследования показали, что экспериментальное соединение, предназначенное для герметизации клеточных мембран — р 188, улучшает работу сердца у собак с дефицитом дистрофина.
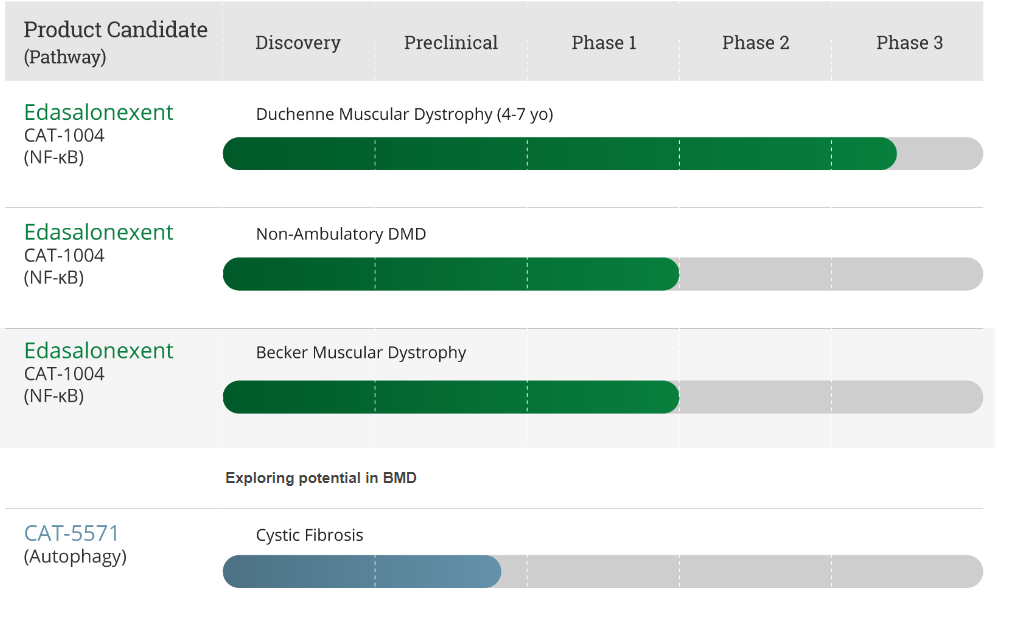
В 2011 году исследователи при поддержке MDA обнаружили, что ингибирование действия белка NF-kappa B улучшает сердечную функцию у мышей с тяжелой болезнью, подобной МДД. Фармацевтическая компания Catabasis, предоставляет на своем официальном сайте инфографический материал о препарате Edasalonexent (CAT-1004) — ингибиторе белка NF-kappa B.
График исследований Сatabasis
Согласно информации, представленной в данном графике, в настоящее время изучается потенциал препарата Edasalonexent (CAT-1004) при лечении МДБ2.
Генное редактирование — CRISPR/Cas9
Метод CRISPR/Cas9 основан на естественной системе защиты бактерий от вирусной инфекции (аналог иммунной системы). Когда бактерия обнаруживает наличие чужеродной (в данном случае вирусной) ДНК, CRISPR белок захватывает часть вирусной ДНК и вставляет этот фрагмент в собственный геном бактерии. Затем бактерии используют «иммунизирующий» фрагмент вирусной ДНК для производства «антител», которые распознают и защищают от будущих вирусных атак3.
Бактериальные «антитела» включает в себя два типа коротких РНК,которые образуют комплекс с белком Cas9. Cas9 — это нуклеаза (тип фермента, способный разрезать ДНК). Когда соответствующая вирусу последовательность нуклеотидов (гидовая РНК) обнаруживает цель в геноме вируса, Cas9 вырезает вирусную ДНК, блокирует вирус и препятствует его репликации.
Как CRISPR/Cas9 может быть использован в лечении мышечной дистрофии?
Система CRISPR/Cas9 может быть задействована для изменения или исправления мутаций в клетках пациентов. Исследователи работают над тем, чтобы найти лучший способ лечения различных типов мышечной дистрофии (и других генетических заболеваний) с помощью данного метода.
Первые клинические испытания CRISPR/Cas9 с участием человека для лечения таких заболеваний как рак или муковисцидоз, находятся в процессе разработки. В данных испытаниях клетки пациента изолируются, обрабатываются для исправления генетической мутации, а затем вводятся обратно пациенту для борьбы с болезнью.
Для мышечной дистрофии вирусная система доставки могла бы обеспечить клетки пациента инструкциями для синтеза белка Cas9, так же как и гидовые РНК, которые нацелены на определенные области ДНК.
Рассмотрим пример с мышами, болевшими МДД. Заболевание обусловлено мутациями в гене, который содержит инструкции для производства дистрофина. После проведения лечения системой CRISPR/Cas9, удалось восстановить функцию дистрофина в мышечных клетках мышей.
Похожие доклинические исследования проводятся для оценки потенциала системы CRISPR/Cas9 в лечении других типов мышечной дистрофии.
Для получения подробной информации — к ознакомлению доступны более 200 статей по CRISPR/cas-9 на сайте журнала Биомолекула https://biomolecula.ru/search/crispr
Генная терапия
Генная терапия, или перенос генов, относится к доставке генов в качестве терапевтических агентов. Поскольку гены содержат инструкции по синтезу белка, это прямо или косвенно будет считаться терапией для нервно-мышечных заболеваний. Так как, перенесенные гены потенциально могут продолжать продуцировать белок в течение некоторого времени, генная терапия может предложить более надежное решение, чем другие методы лечения. При этом, генная терапия сталкивается со многими техническими проблемами, а также с особым контролем, установленным регулирующими органами, такими как Управление по контролю за продуктами и лекарствами США (FDA), что не позволяет генной терапии быть клинически применимым методом в настоящее время.
Ключевыми проблемами являются доставка генов в целевую ткань, избегая при этом нежелательных тканей и нежелательного иммунного ответа на белки, полученные из новых генов, или на средства доставки новых генов.
Ученые при поддержке MDA создали уменьшенный рабочий ген дистрофина, который был протестирован у мальчиков с МДД. Хотя лечение казалось безопасным, некоторые из мальчиков испытывали нежелательный иммунный ответ на белок дистрофина, который ограничивал эффективность переноса гена. Этот иммунный ответ подвергается дальнейшему исследованию.
Ингибирование миостатина
Блокирование белка миостатина с помощью белка фоллистатина, представляет собой стратегию, которая имеет потенциал для лечения МДД и, вероятно, многих других нервно-мышечных заболеваний. Мыши с похожим на МДД заболеванием, получавшие гены белка фоллистатина, показали общее увеличение массы тела и веса отдельных мышц. У обезьян, которым был выполнен перенос гена фоллистатина, были более сильные и крупные мышцы.
Стратегия, получившая значительную поддержку MDA, заключается в подавлении действия белка природного происхождения, ограничивающего рост мышц- миостатина. Исследователи надеются, что блокирование миостатина может позволить мышцам расти больше и сильнее.
Ингибиторы миостатина привлекают большое внимание сообщества исследователей нервно-мышечных заболеваний с тех пор, как несколько лет назад было обнаружено, что люди и животные с генетическим дефицитом миостатина имеют большие мышцы и хорошую силу без видимых побочных эффектов. В 2010 году исследование показало, что мыши, лишенные дистрофина и имеющие заболевание, подобное МДД, получили пользу от лечения «приманкой», которая «выманивала» миостатин из их мышц.
Затем биотехнологическая компания Acceleron Pharma разработала препарат на основе этой «приманки» и начала его тестирование при поддержке MDA у мальчиков с МДД. К сожалению, во время этого испытания возникли неожиданные проблемы безопасности, в результате чего Acceleron прекратил его в 2011 году.
Компания надеется решить эти проблемы безопасности и возобновить тестирование ACE-031 или модифицированной версии ACE-031.
На сайте Clinicaltrials.gov можно ознакомиться с результатами исследования препарата ACE — 031 для пациентов с МДД4.
Другие стратегии ингибирования миостатина, такие как инъекция генов для миостатин-блокирующего фоллистатина, также находятся на рассмотрении.
Стволовые клетки
Стволовые клетки — это клетки на самых ранних стадиях развития. Они могут превратиться в специальный тип клеток (например, мышечные или нервные клетки), или сохранять плюрипотентность — способность развиваться в любой из ряда различных типов клеток.
Трансплантация стволовых клеток предлагается в качестве лечения таких заболеваний, как мышечная дистрофия. На основе клеточной терапии предпринимались попытки стимулировать регенерацию мышц с надеждой на то, что стволовые клетки восстановят мышечную функцию и исправят патологию путем повторного синтеза мышц. Стволовые клетки рассматриваются как подходящий вариант для терапевтического применения из-за их способности к самовосстановлению и потенциала дифференцировки.
В 2006 году при поддержке исследователи при поддержке Ассоциации мышечных дистрофий (MDA) восстановили подвижность у двух собак и стабилизировали функцию у третьей, используя стволовые клетки, взятые из мышечных кровеносных сосудов.
В исследовании, опубликованном в 2007 году, европейская исследовательская группа успешно использовала комбинацию генетической коррекции и стволовых клеток для лечения мышей с МДД. Исследователи в этом исследовании извлекали генерирующие мышцу стволовые клетки из мышечной ткани и крови у людей с МДД, исправляли генетическую ошибку в генах дистрофина клеток, а затем вводили клетки мышам с дефицитом дистрофина. Клетки, полученные из мышц, вызывали лучшую регенерацию мышц, чем клетки, полученные из крови.
В 2010 году французские ученые при поддержке MDA сообщали, что они идентифицировали ранее неизвестный тип мышечных стволовых клеток, расположенных в промежутках между мышечными волокнами у мышей. Хотя все это еще на ранних стадиях исследований, есть надежда, что новые клетки, получившие название PICs, могут играть важную роль в регенерации и восстановлении мышц.
В этом же году по утверждениям исследователей считалось, что для формирования новой мышечной ткани сначала требуется контролируемый тип повреждения ДНК. Новое открытие расширило понимание ученых о том, как незрелые мышечные клетки становятся мышцами, и помогло им управлять этим процессом для лечения нескольких форм мышечной дистрофии.
Стволовые клетки продолжают оставаться основной областью исследований для специалистов и исследователей в сфере нервно-мышечных заболеваний. Некоторые продолжают изучать мышечные сателлитные клетки, тип стволовых клеток, присутствующих в мышечной ткани. Другие изучают различные типы клеток, которые способны пережить трансплантацию в мышцы и продуцировать желаемые белки. Кроме того изучаются сходства и различия в развитии скелетных мышц и жировой ткани.
В последние годы (с 2013 по 2020 гг) были получены обнадеживающие результаты лечения человека с использованием зрелых стволовых клеток. Так проф. Sharma при участии соавторов., в 2013 году изучали эффект внутримышечной аутотрансплантации мезенхимальных стволовых клеток костного мозга у 150 пациентов с мышечной дистрофией (имеются ввиду стволовые клетки. Через 12 месяцев наблюдения у пациентов наблюдалось увеличение мышечной силы и улучшение походки. Симптоматические и функциональные улучшения также наблюдались в 86,67% случаев: у шести пациентов снижен уровень жировой инфильтрации и выявлена регенерация мышц на снимках МРТ , а у девяти — выявлены положительные изменения электрической активности мышц на электронейромиографии (ЭНМГ).
Мезанхимальные стволовые клетки состоят из множества клеток, таких как гематопоэтические стволовые клетки, тканеспецифические клетки-предшественники, стромальные клетки и специализированные клетки крови на разных стадиях развития5. Эти клетки обладают способностью мобилизовать и оказывать свои репаративные эффекты в месте повреждения. Они способствуют неоваскуляризации и усиливают ангиогенез (образование сосудов), продуцируя сигнальные молекулы, такие как факторы роста эндотелия сосудов и факторы роста фибробластов (FGF2). Они также способствуют ремоделированию тканей, предотвращают апоптоз (отмирание клеток), уменьшают воспаление, высвобождают факторы роста и активируют сателлитные клетки. Это паракринные эффекты, которые могут помочь в достижении желаемого результата клеточной терапии6,7. Аутологичные мезенхимальные стволовые клетки костного мозга были использованы в этом случае, потому что они не имеют этических проблем, и его безопасность была установлена (не требуется донор, это клетки самого пациента).
Трансплантация стволовых клеток в нужное место мышечного тела, как правило, является основной практической трудностью. Внутривенное введение стволовых клеток, полученных из костного мозга, показало успешное возвращение стволовых клеток в поврежденные мышечные ткани на моделях животных; однако это также рискует разбавлением концентрации клеток. Мышечная дистрофия в основном воспринимается как заболевание мышц, с малым количеством свидетельств нервно-мышечных поражений. Дистрофин является частью структурного белка, обнаруженного в миелине, образующего клетки Шванна и нервы. Демиелинизация и дегенерация как изменения в нервах могут происходить с такими нарушениями в клетках. Поэтому были выбраны два различных способа трансплантации клеток: внутримышечный и интратекальный. Мезенхимальные клетки костного мозга вводили в двигательные точки целевых слабых мышц для восстановления иннервирующего нерва, а также мышц. Известно, что спинномозговая жидкость содержит факторы роста, которые помогают росту коркового эпителия и стимулируют васкуляризацию в нервной системе, поэтому он использовался в качестве разбавляющей среды.
Особый интерес вызывает клинический случай пациента с мышечной дистрофией Беккера, в отношении которого была проведена терапия с использованием мезанхемальных клеток костного мозга.
Результаты были обнадеживающими. После клеточной терапии пациент дважды наблюдался в стационаре через 3 и 9 месяцев. Спустя 3 месяца было отмечено улучшение двигательной функции верхних конечностей. Выполнение движений над головой требовало сравнительно меньших усилий. Наблюдалось двустороннее снижение жесткости и псевдогипертрофии икроножных мышц . Отмечались значительные улучшения в положении стоя и сидя, в способности держать равновесие. Баланс в положении стоя и при ходьбе улучшился. Частота падений при ходьбе заметно уменьшилась с 4-5 падений в месяц до 1 падения за 3 месяца. Характеристики дыхательной функции также улучшились: жизненная емкость легких (ЖЕЛ) (с 1250 мл до 1750 мл) и пиковая скорость выдоха (ПСВ) (с 290 мл до 360 мл).
Более подробно читайте запись «Эффективность клеточной терапии при прогрессирующей мышечной дистрофии Беккера»8.
Усиление атрофина
Лабораторные данные показывают, что повышение уровня мышечного белка атрофина может, до некоторой степени, компенсировать дефицит дистрофина.
Утрофин очень похож на дистрофин, но, в отличие от дистрофина, обычно вырабатывается и полностью функционирует при МДБ. Следовательно, повышение уровня атрофина вряд ли вызовет нежелательный иммунный ответ, тогда как повышение уровня дистрофина может это сделать. Увеличение производства атрофина может помочь компенсировать дефицит дистрофина независимо от специфической мутации гена дистрофина.
Хотя по структуре и функции атрофин близок к дистрофину, между этими двумя белками есть как минимум одно ключевое отличие. Во время развития плода и, возможно, немного позднее, атрофин присутствует по всему мышечному волокну, взаимодействуя с кластерами белков, застрявшими в окружающей его мембране. По мере взросления животного или человека атрофин почти полностью заменяется дистрофином, за одним исключением. На нервно-мышечном соединении атрофин остается на протяжении всей жизни.
Несколько стратегий в настоящее время пытаются увеличить атрофин. Одним из них является выявление и подавление всего, что препятствует выработке атрофина — найти тормоз и, так сказать, отпустить его.
Другая стратегия заключается в том, чтобы ввести модифицированную версию самого белка атрофина в организм. Исследование, проведенное в 2009 году, показало, что модифицированный протеин атрофина дает значительные преимущества при введении мышам, у которых отсутствует белок дистрофина и которые имеют заболевание, напоминающее МДД.
В 2011 году ученые сообщили, что системное введение человеческой формы белка, называемого бигликан, мышам с болезнью, подобной МДД , повышает устойчивость мышечных мышц к повреждениям, связанным с их сокращением.
ReveraGEN и Vamorolone
Препарат Vamorolone снижает воспаление в мышцах, что эффективно тормозит прогрессию мышечной дистрофии. При этом в отличие от традиционных глюкокортикостероидов, применяемых в лечении мышечных дистрофий, препарат не имеет таких нежелательных побочных эффектов.
В марте 2019 года от МОО «Проект Ай-Мио» на конференции Myology 2019 побывали Бережной Дмитрий и Екатерина Чернец. Нам стало известно, что компания Reveragen планирует провести исследование препарата Vamorolone для пациентов с мышечной дистрофией Беккера.
В мае 2019 года удалось выйти на связь с Eric’ом Hoffman’ом, руководителем компании Reveragen.
Мы получили следующую информацию:
«Мы (Reveragen) подали заявку на грант для возможного финансирования правительством США небольшого «пилотного испытания» Vamorolone при мышечной дистрофии Беккера. Нам нужно подождать несколько месяцев, чтобы узнать, предоставит ли правительство финансирование. Если это состоится, то экспериментальные испытания могут начаться через год или около того, и с ограниченным количеством пациентов в пилотном исследовании, набор пациентов может быть также ограничен Питтсбургом и Падуей, Италия — но все эти детали еще не проработаны.»
Мы будем следить за новостями, обновления будут размещены здесь и в разделе сайта «Блог».
Источники:
1. Muscular dystrophy Association — исследования терапевтических стратегий для мышечной дистрофии Беккера
2. Catabasis.com — график исследований CAT — 1004
3. Musculardystrophynews.com — о CRISPR/Cas-9
4. Clincaltrials.gov — результаты исследований ACE — 031
5. Sharma A., Gokulchnadran N, Sane H, Badhe P. 3rd eds Stem cell therapy in neurological disorders. NeuroGen Brain and Spine Institute, Navi Mumbai, India: 2015 [Google Scholar]
6. Vandervelde S, Luyn V. M., Tio J, Harmsen MC. Signaling factors in stem cell mediated repair of infarcted myocardium. J Mol Cell Cardiol 2005; 39:363-76. [PubMed] [Google Scholar]
7. Gnecchi M, Zhang Z, Ni A, Dzau VJ. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research 2008;103:1204-19. [PMC free article] [PubMed] [Google Scholar]
8. Clinical trials.gov — эффективность клеточной терапии при мышечной дистрофии Беккера
Перевод и материалы подготовлены: Бережной Д.С., Чернец Е.Н.