Рассмотрим материалы статьи «Vamorolone improves Becker muscular dystrophy and increases dystrophin protein in bmx model mice» авторов Nikki M.McCormack, Nhu Y. Nguyen, Christopher B. Tully, Trinitee Oliver, Alyson A. Fiorillo, Christopher R. Heier (перевод на русский язык выполнила волонтер ProCharity — София Шерстнева, а также Дмитрий и Екатерина Бережные)
Резюме
Не существует утвержденной терапии для лечения мышечной дистрофии Беккера (МДБ) — генетического заболевания, вызванного делецией дистрофина. Ранее мы разработали диссоциированный кортикостероид Ваморолон для лечения аллельной, дистрофин-нулевой болезни — мышечной дистрофии Дюшенна. Мы предполагаем, что Ваморолон может лечить МДБ за счет безопасного снижения воспалительных сигналов в мышцах и благодаря новому механизму увеличения белка дистрофина через подавление миРНК, нацеленных на дистрофин. Мы проверили это на мышах с геном bmx. Ежедневное пероральное лечение Ваморолоном или Преднизолоном улучшает силу хвата у мышей bmx и фенотипы времени ожидания. Оба препарата уменьшают размер миофибрилл и снижают процент центрально-ядерных волокон. Ваморолон демонстрирует повышенную безопасность по сравнению с Преднизолоном, избегая или уменьшая основные побочные эффекты, влияющие на поведение и рост. Интересно, что Ваморолон увеличивает количество белка дистрофина как в сердечной, так и в скелетной мышцах. Эти данные свидетельствуют о том, что Ваморолон, который скоро будет одобрен для лечения болезни Дюшенна, демонстрирует эффективность на bmx мышах и, следовательно, заслуживает клинического исследования при МДБ.
Введение
Мышечная дистрофия Беккера (МДБ) – это мышечное заболевание, вызываемое внутрикрамочными мутациями дистрофина, приводящими к проявлению сокращенных изоформ дистрофина, которые часто выражаются понижением его уровня. Пациенты с МДБ имеют различную степень тяжести заболевания — от бессимптомного до такого тяжелого, как мышечная дистрофия Дюшенна (МДД) — заболевание, вызванное в первую очередь мутациями дистрофина, приводящими к полной потере [белка] дистрофина. У многих пациентов с МДБ наблюдаются двигательные нарушения и до 50 % пациентов с МДБ умирают от кардиомиопатии.
Разработка лекарств для лечения МДБ была затруднена отсутствием подопытных мышей и в настоящее время в клинических испытаниях МДБ участвуют только два препарата по сравнению с примерно 30 препаратами, проходящими клинические испытания для МДД. В настоящее время не существует одобренного лечения МДБ.
Стандартом лечения МДД является хронический прием глюкокортикоидов, таких как преднизолон и дефлазакорт, которые замедляют прогрессирование заболевания за счет подавления воспаления путем ингибирования NF-kB-сигналов. Однако хроническое применение традиционных глюкокортикоидов также активирует пути, которые вызывают неблагоприятные побочные эффекты, включая задержку роста, проблемы с поведением, диабет, потерю костной массы [деминерализацию костей и как следствие остеопороз], чрезмерное увеличение веса и иммунодепрессию. Традиционные глюкокортикоиды редко назначаются пациентам с МДБ из-за их тяжелых побочных эффектов и неясной эффективности. Неизвестно, как кортикостероиды влияют на функцию и патологию МДБ.
Ранее мы продемонстрировали, что первый в своем классе диссоциативный кортикостероид ваморолон — препарат двойного действия, который является селективным агонистом глюкокортикоидных рецепторов (GR), а также антагонистом минералокортикоидных рецепторов (MR), улучшает течение болезни у мышей mdx, обходя при этом пути побочного действия GR-трансактивации, которые активируются традиционными глюкокортикоидами. Помимо действия в качестве агониста GR, мы обнаружили, что ваморолон действует как антагонист MR и улучшает состояние сердца mdx, в то время как преднизолон, агонист MR, усиливает фиброз и ухудшает функцию сердца. В отличие от традиционных глюкокортикоидов, улучшенный профиль безопасности и кардиопротекторные свойства ваморолона позволяют предположить, что он может стать безопасным и эффективным средством лечения пациентов с МДБ. В ходе рандомизированного двойного слепого плацебо-контролируемого исследования ваморолона при МДД, он показал равную с преднизоном эффективность и при этом уменьшил связанные с кортикостероидами проблемы безопасности, такие как замедление роста.
МикроРНК, нацеленные на дистрофин (DTMs), связываются с 30 [тридцатой] нетранслируемой областью (UTR) транскрипта дистрофина и снижают экспрессию белка. Экспрессия DTM, таких как miR-146a, повышается под влиянием воспалительного NF-kB-сигнала, что приводит к повышению экспрессии DTM при мышечных заболеваниях с воспалительным компонентом, таких как МДБ, МДД и миозит. Соответственно, противовоспалительные препараты, такие как преднизолон и ваморолон, снижают экспрессию DTM у мышей mdx. Аналогичное повышение экспрессии и противовоспалительный ответ на лекарства для miR-146a наблюдаются у людей с другими воспалительными заболеваниями, такими как воспалительные заболевания кишечника. Эти данные позволяют предположить, что ваморолон также может быть полезен для МДБ за счет повышения уровня дистрофина и подавления DTM.
Мышь bmx представляет собой первую доклиническую подопытную мышь МДБ с CRISPR-индуцированной делецией экзонов 45-47 эндогенного дистрофина, что моделирует наиболее распространенную мутацию у пациентов с МДБ и ассоциируется с более тяжелой патологией скелетных мышц и сердечными исходами. Ваморолон, разработанный для клинического применения в ходе доклинических испытаний на мышах mdx, представляет собой препарат, который может безопасно лечить хронические воспалительные сигналы, мышечную патологию, слабость, кардиомиопатию и низкий уровень дистрофина в МДБ. Здесь мы исследуем влияние ваморолона в сравнении с традиционным глюкокортикоидом — преднизолоном на течение болезни у мышей bmx. Без лечения мыши bmx имеют промежуточные фенотипы по сравнению с мышами дикого типа (WT) и мышами mdx52. В данном случае мы обнаружили, что ежедневный прием ваморолона повышает двигательную функцию bmx, улучшает патологию скелетных мышц и уменьшает экспрессию патологических генов. Ваморолон позволяет избежать побочных эффектов хронического лечения преднизолоном, включая тревожность и задержку роста. Мы обнаружили, что ваморолон также увеличивает количество белка дистрофина и снижает экспрессию DTM как в сердечной, так и в скелетной мышце. Наши данные представляют собой первое доклиническое исследование, подтверждающее разработку препарата для лечения МДБ, и дают новое представление о потенциале диссоциативных стероидов, таких как ваморолон, для более широкого лечения мышечных заболеваний с хроническим воспалением, кардиомиопатией, альтернативными изоформами дистрофина или сниженным уровнем дистрофина.
Результаты
Ваморолон безопасно улучшает двигательную функцию мышей bmx.
Мы начали с изучения влияния ваморолона на силу и поведение дистрофичных мышей. В их естественной среде мыши bmx возрастном 10 недель имеют нарушения двигательной функции, средние по сравнению с дикими особями (WT) и mdx мышами. Здесь, начиная с 6-недельного возраста, рандомизированные и группы мышей bmx слепого метода получали лечение ваморолоном (20 мг/кг/сут) или преднизолоном (5 мг/кг/сут), используя ежедневное пероральное введение препаратов посредством вишневого сиропа (n = 12 на группу). Эти дозы были выбраны на основе нашего обширного опыта в мышиной модели МДД mdx. Мы использовали 5 мг/кг преднизолона, т.к. эти дозы являются безопасными и эффективными для мышей mdx. Мы показали, что дозы ваморолона 5-45 мг/кг хорошо переносятся мышами mdx, и в данном случае мы используем 20 мг/кг ваморолона, так как ранее мы установили, что эта доза была безопасной и эффективной для лечения мышечной и сердечной недостаточности mdx.
Преднизолон (увеличение на 38,4%, p = 0,0041) и ваморолон (увеличение на 40,5%, p = 0,0035) (увеличение времени подвешивания) продемонстрировали эффективность за счет значительного увеличения сил мыши, определяемой по времени пребывания в подвешенной коробке на четырех конечностях.(рис. 1А). Две мыши, после терапии могли висеть в течение всех 10 минут этого теста, по крайней мере семь мышей в каждой группе были способны висеть в течение полных 10 минут. Время подвешивания в проволочном тесте [тест при котором мышей подвешивали] на двух конечностях также значительно увеличивалось при использовании преднизолона (172,9%, p = 0,0348) и незначительно в группе, обработанной ваморолоном (129,6 %, p = 0,0694) (рис. 1B). При оценке силы хвата передней конечности, оба препарата показали скромные улучшения, которые не достигли значимости (Рисунок 1С). Для силы хвата задней конечности, как преднизолон (увеличение на 17,5%, p = 0,0007), так и ваморолон (увеличение на 11,7%, p = 0,0117) значительно увеличили силу хвата у мышей модели BMD (рис. 1D). Эти эффекты согласуются с терапевтической эффективностью ваморолона и преднизолона в отношении фенотипов силы мышц bmx.
Тревожное поведение в лабиринте «плюс», а также замедление роста были оценены как показатели безопасности препарата. Для оценки тревожного поведения мышей bmx после терапии помещали в приподнятый «плюс» лабиринт, и их движения регистрировались в течение 5 минут. Приподнятый плюс-лабиринт состоит из двух открытых участков без стен и двух закрытых, огороженных стенами. Мыши, испытывающие тревогу, будут избегать проводить время в открытых зонах и [вместо этого будут проводить больше времени] в защищенных закрытых зонах лабиринта, в то время как не испытывающие тревоги мыши, будут исследовать как открытые, так и закрытые участки лабиринта. (рис. 1E). Мыши, после перапии преднизолоном, провели значительно больше времени в безопасных закрытых участках (увеличение на 14,8 %, p = 0,02) и значительно меньше времени (32,4 % уменьшение, p = 0,0084) в открытых участках лабиринта «плюс» по сравнению с мышами после терапии аналогом плацебо (рис. 1F и 1G). В отличие от этого, время, проведенное в открытых и закрытых лабиринтах, не отличалось между мышами, после терапии инертным веществом, и мышами после терапии ваморолоном (рис. 1F и 1G). Это соответствует тому, что преднизолон вызывает повышенную тревожность, в то время как ваморолон позволяет избежать этого эффекта. По окончании испытания мы также обнаружили, что преднизолон значительно уменьшил длину тела (снижение на 2,6 %, p = 0,0092) и массу тела (снижение на 9,3 %, p = 0,023; рис. 1H и 1H), что соответствует задержке роста. В предыдущем исследовании лечение мышей mdx преднизолоном в более раннем возрасте (от 2 до 8 недель) привело к более значительному снижению длины тела на 6,3%. У мышей bmx после лечения ваморолоном, не наблюдалось значительной разницы в длине тела, что соответствует результатам предыдущих исследований на мышах mdx, получавших ваморолон в дозе до 45 мг/кг с 2 до 8 недель. Эти данные согласуются с улучшенным профилем безопасности диссоциативного стероида ваморолона по сравнению с традиционными глюкокортикоидами у пациентов с МДД.
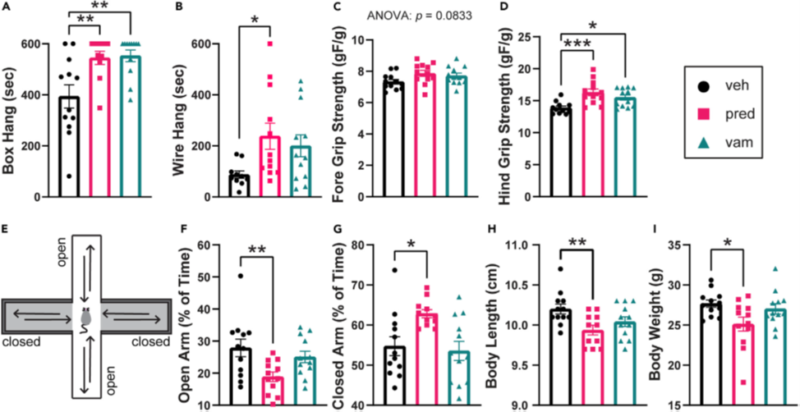
Рисунок 1. Ваморолон безопасно улучшает силу мышей bmx
Мыши получали ежедневно перорально инертное средство (вишневый сироп), ваморолон (; 20 мг/кг/сут) или преднизолон ( 5 мг/кг/сут), начиная с 6-недельного возраста.
(A) Преднизолон и ваморолон значительно увеличивали время зависания в тесте на подвешивание в коробке.
(B) Преднизолон значительно увеличил время зависания в тесте с подвешиванием на проволоке, в то время как время зависания увеличилось при использовании ваморолона.
(C и D) Преднизолон и ваморолон не влияли на силу хвата передней конечности, но значительно увеличивали силу хвата задней конечности. n = 12 мышей на группу.
(E) Схема приподнятого плюсового лабиринта. Лабиринт состоит из двух открытых участков (без стен) и двух защищенных, закрытых участков (огороженных стенами). Мышей помещают в центр лабиринта и дают им возможность исследовать его в течение 5 минут.
(F и G) В приподнятом плюсовом лабиринте мыши, обработанные преднизолоном, проводили значительно меньше времени в открытых и значительно больше в закрытых рукавах.
В то время как у мышей, обработанных ваморолоном, не наблюдалось значительных изменений во времени, проведенном в открытых или закрытых участках .n = 12 на группу.
(H и I) У мышей, обработанных преднизолоном, значительно уменьшились длина и вес тела. Масса и длина тела не изменились при лечении ваморолоном.
n = 12 на группу. Данные проанализированы с помощью одностороннего дисперсионного анализа ANOVA с последующим тестом множественных сравнений Холма-Сидака. Данные представлены как среднее значение G S.E.M. *p ≤ 0,05, **p ≤ 0,01, ***p ≤ 0,001.
Ваморолон уменьшает псевдогипертрофию и патологию скелетных мышц
После 10 недель лечения мы определили вес тканей и провели измерения конечных точек. У пациентов с МДБ характерно увеличение икроножных мышц, несмотря на то, что эти мышцы слабее. Это называется псевдогипертрофией и встречается как у пациентов с МДД, так и у мышей mdx. Такая псевдогипертрофия является результатом увеличения количества неконтрактильной ткани и разветвления миофибрилл, причем неконтрактильная ткань включает в себя сочетание воспаления, дегенерации/регенерации тканей, фиброза и инфильтрации жировой ткани. Ранее мы показывали, что у мышей bmx развивается мышечная псевдогипертрофия, соответствующая МДБ, и увеличенная селезенка, соответствующая состоянию хронического воспалительного заболевания. Здесь мы обнаружили, что преднизолон и ваморолон значительно уменьшали псевдогипертрофию скелетных мышц в икроножной, передней большеберцовой мышце и четырехглавой мышце (рис. 2A-2C). Мы не наблюдали значительного влияния на массу диафрагмы и сердца (рис. 2D и 2E). Оба препарата значительно уменьшили массу селезенки (рис. 2F). Эти изменения согласуются с эффективностью лечения дистрофических мышц и воспаления у мышей с МДБ.
Далее мы оценили гистопатологию миофибрилл, учитывая, что у мышей bmx в результате болезни увеличивается процент центрально-ядерных волокон (ЦЯВ) и изменяется размер миофибрилл. При исследовании икроножной мышцы оказалось, что лечение как ваморолоном, так и преднизолоном привело к значительному уменьшению количества ЦЯВ у мышей bmx. Миофибриллы в икроножной мышце также показали значительно уменьшенный средний минимальный диаметр Ферета и среднюю площадь поперечного сечения миофибриллы, а также наблюдалась тенденция к уменьшению вариабельности размеров волокон (рис. 3C и 3D). В передней большеберцовой мышце оба препарата вызывали значительное уменьшение среднего минимального диаметра Ферета и средней вариабельности размера волокон, а ваморолон значительно уменьшал вариабельность минимального диаметра волокон Ферета (рис. S1). В соответствии с воздействием на псевдогипертрофию икроножных мышц, которая является ключевым фенотипом пациентов с МДБ, эти данные демонстрируют эффективность в лечении мышечной патологии bmx.
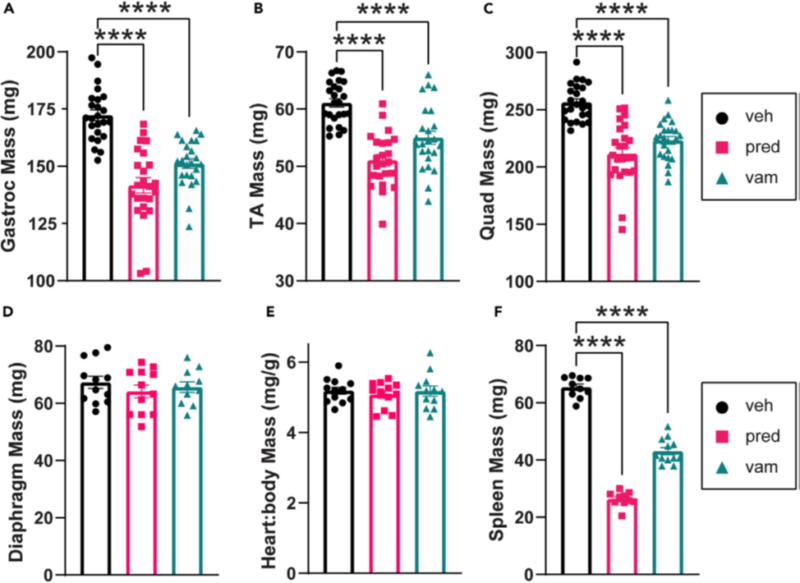
Рисунок 2. Лекарственные препараты уменьшают псевдогипертрофию мышц при bmx
(A-C) Преднизолон и ваморолон уменьшают массу [псевдогипертрофированной] икроножной мышцы, передней большеберцовой и четырехглавой мышц. n = 24 на группу.
(D) Преднизолон и ваморолон не изменяли массу диафрагмы. n = 12 на группу.
(E) Масса сердца по отношению к массе тела не претерпела значительных изменений в результате лечения преднизолоном и ваморолоном.
(F) Масса селезенки значительно уменьшается при лечении преднизолоном и ваморолоном. n = 12 на группу. Данные проанализированы с помощью одностороннего дисперсионного анализа ANOVA с последующим тестом множественных сравнений Холма-Сидака. Данные представлены как среднее значение G S.E.M. *p ≤ 0,05, **p ≤ 0,01, ****p ≤ 0,0001.
Ваморолон снижает проявление патологических генов в скелетных мышцах bmx
Помимо мышечной слабости и фенотипов миофибрилл, у мышей bmx наблюдается увеличение количества инфильтрирующих иммунных клеток и повышенное проявление воспалительных генов и микроРНК, что соответствует хроническому воспалительному заболеванию. Анализ окрашенных гематоксилином и эозином поперечных срезов икроножноый и передней большеберцовой мышц не выявил различий в процентном соотношении площади некроза и воспаления (рис. S2A, S2B, S3A,и S3B).
Далее мы исследовали панель воспалительных мРНК и миРНК. Лечение преднизолоном и ваморолоном значительно снижало проявление воспалительных генов, включая Ccl2, Il-6, Irf1 и Tnf в икроножной мышце bmx (рис. 4A и 4B). Аналогичные эффекты наблюдались и в передней большеберцовой мышце, где количество воспаленных генов снижалось как при лечении как преднизолоном, так и ваморолоном (рис. S3C и S3D). В соответствии с мРНК, проявление миРНК, регулируемых при воспалении, также значительно снижалась при лечении преднизолоном и ваморолоном в икроножной мышце bmx (рис. 4C-4E).
Уровни DTM, включая miR-146a и miR-31, значительно снижены в икроножной мышце при лечении преднизолоном и ваморолоном (рис. 4C и 4D). В ТА уровни miR-146a и miR-223 значительно снижаются под действием преднизолона, в то время как DTM не снижается в передней большеберцовой мышце при приеме ваморолона (рис. S3E и S3F). Уровни miR-142-3p и miR-142-5p не изменились при приеме преднизолона и ваморолона в ТА (рис. S3E и S3F). Уровни miR-455-5p значительно снижаются при приеме преднизолона и незначительно при приеме ваморолона, в то время как уровень miR-497 значительно снижается при обоих видах лечения (рис. S3E и S3F). В мышцах мышей bmx наблюдается повышенное проявление фиброзных генов. Лечение как ваморолоном, так и преднизолоном вызывают значительное снижение проявления генов фиброза в икроножной мышце, включая Col3a1, Col6a1, Fn1 и Mmp2 (рис. 4F и 4G). Аналогичные эффекты наблюдались в мышцах ТА (рис. S4H и S4I).
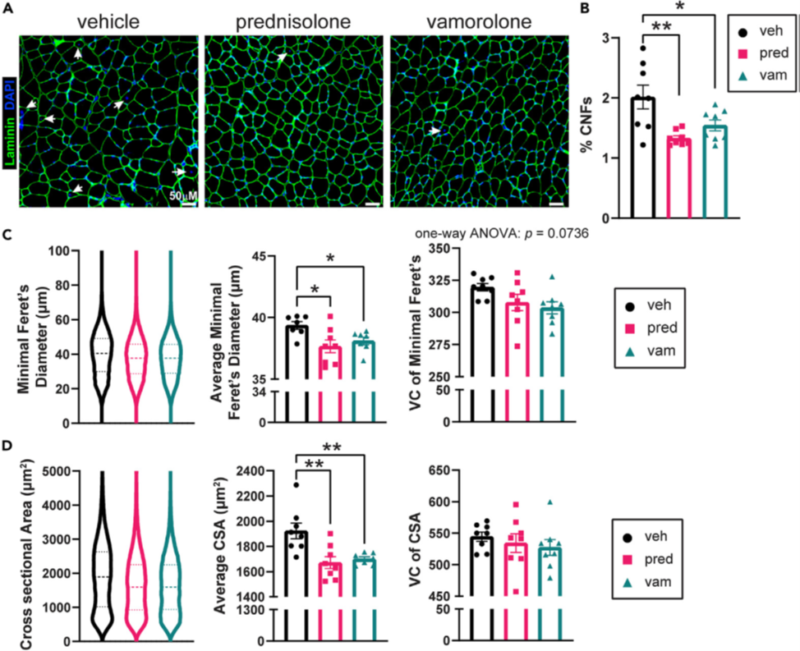
Рисунок 3. Лечение уменьшает патологию миофибры
(A) Поперечные срезы икроножной мышцы были окрашены ламинином и DAPI для визуализации мембран и ядер миофибрилл.
Белые стрелки обозначают центрально-ядерные волокна (ЦЯВ). Масштабная линейка = 50 мм.
(B) Процент ЦЯВ значительно снижался под действием преднизолона и ваморолона.
(C) Минимальный диаметр Феретта определяли для каждой из миофибрилл с помощью MuscleJ и рассчитывали коэффициент дисперсии (КД). Средний минимальный диаметр Феретта значительно уменьшился при приеме преднизолона и ваморолона. Колебания минимального диаметра Ферета были незначительно снижены под действием ваморолона.
(D) Площадь поперечного сечения (CSA) определяли для каждой миофибриллы с помощью MuscleJ и рассчитывали КД. Средняя CSA значительно снижалась при приеме преднизолона и ваморолона. КД CSA не изменился при лечении преднизолоном и ваморолоном. n = 8 на группу. Данные проанализированы с помощью одностороннего дисперсионного анализа ANOVA с последующим тестом множественных сравнений Холма-Сидака. Данные представлены как среднее значение G S.E.M. *p ≤ 0,05, **p ≤ 0,01. См. также рисунок S1.
Ваморолон снижает показатели воспаления и фиброза в сердце
Ранее мы показали, что в сердцах с bmx повышены показатели воспалительных и фиброзных генов. Здесь, мы обнаружили, что преднизолон и ваморолон значительно снижают экспрессию многих воспалительных генов, включая Ccl2, Il-6, Irf1 и Tnf (рис. 5A и 5B). Оба вида лечения значительно снижают уровни DTM miR-146a и miR-31 (рис. 5C и 5D). Уровни miR-497 и miR-455 значительно снижались под действием ваморолона, но не преднизолона (рис. 5C и 5E). Преднизолон и ваморолон также значительно снижают экспрессию многих фиброзных генов в сердце, включая Col1a1, Col3a1, Col6a1 и Tnc (рис. 5F и 5G). Далее мы окрашивали срезы сердца Sirius red fast green для визуализации и количественной оценки фиброза. Мы не обнаружили явных признаков фиброза в этом возрасте ни в одной из групп мышей bmx и не выявили статистических различий в процентной доле фиброзных пятен при лечении преднизолоном или ваморолоном (Рисунок S4A). Мы также окрашивали срезы сердца с IgM для оценки повреждения сердца и не обнаружили IgM-позитивного окрашивания ни у одной мыши (Рисунок S4B). В совокупности эти данные свидетельствуют о том, что оба препарата эффективно воздействуют на досимптомные изменения в экспрессии генов, характерные для кардиомиоцитов bmx.
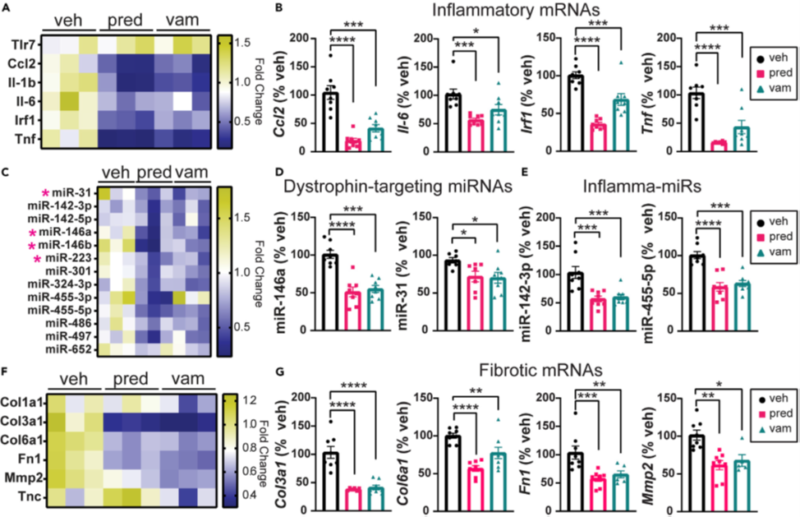
Рисунок 4. Лечение снижает проявление патологических генов в скелетных мышцах bmx
Маркеры воспаления и фиброза определяли с помощью qRT-PCR в икроножной мышце мышей, прошедших лечение.
(A) Тепловая карта проявления воспаления генов в икроножной мышце.
(B) Графики, отражающие проявление воспалительных мРНК в икроножной мышце. Экспрессия Ccl2, Il-6, Irf1 и Tnf значительно снижается при лечении преднизолоном и ваморолоном.
(C) Тепловая карта миРНК, нацеленных на дистрофин (DTM), и воспалительтных миРНК. Розовые звездочки обозначают DTM.
(D и E) Графики, показывающие проявление DTM и воспалительных миРНК в икроножной мышце. Проявление miR-146a, miR-223, miR-142-3p и miR455-5p значительно снижается при лечении преднизолоном и ваморолоном.
(F) Тепловая карта проявления фиброзных генов в икроножной мышце.
(G) Графики, отражающие проявление фибротических генов. Проявление Col3a1, Col6a1, Fn1 и Mmp2 значительно снижается при лечении преднизолоном и ваморолоном n = 8 на группу. Данные проанализированы с помощью одностороннего дисперсионного анализа ANOVA с последующим тестом множественных сравнений Холма-Сидака. Данные представлены как среднее G S.E.M. *p ≤ 0,05, **p ≤ 0,01, ***p ≤ 0,001, ****p ≤ 0,0001. См. также рисунки S2-S4
Ваморолон повышает уровень белка дистрофина
Обнаружив сниженное проявление DTM miR-146a и miR-31, мы изучили уровень белка дистрофина. Иммунофлуоресцентное окрашивание показало, что оба препарата вызывали повышение уровня белка дистрофина в икроножной мышце (рис. 6A). Используя капиллярный электрофорез Уэса для количественного определения белка дистрофина, мы обнаружили, что оба препарата значительно увеличивают количество белка дистрофина. При лечении ваморолоном было обнаружено увеличение дистрофина на 49% (p < 0,0001) в икроножной мышце и на 55% (p = 0,0173) в сердце (рис. 6B и 6C). Подтверждая обратную взаимосвязь между DTM и уровнем белка дистрофина, мы наблюдали значительную обратную корреляцию (p < 0,01) между уровнем белка дистрофина и проявлением трех DTM (miR-31: r = 0,6169; miR-146a: r = 0,6160; miR-223: r = 0,6656), которые снижались в ответ на медикаментозное лечение в икроножной мышце (рис. 6D). Также в соответствии со связью между DTM и белком дистрофином, в другой мышце, где мы наблюдали уменьшение влияния медикаментозного лечения на DTM, мы также не наблюдали значительного влияния на уровень дистрофина (передняя большеберцовая мышца, Рисунки S5A-S5C). В совокупности эти данные согласуются с тем, что DTM регулирует уровень белка дистрофина во время болезни и поддерживают терапевтическую индукцию белка дистрофина в качестве нового терапевтического механизма для ваморолона при МДБ и в качестве сопутствующей терапии МДД с пропуском экзонов.
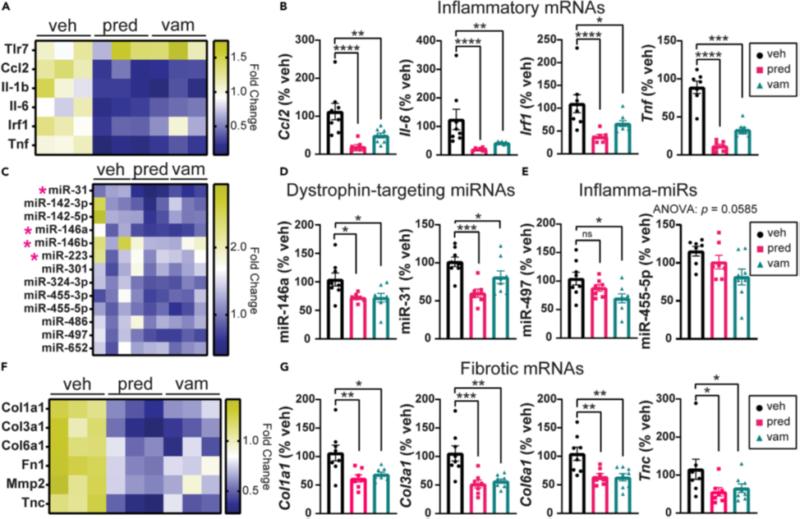
Рисунок 5. Лечение снижает проявление патологических генов в сердцах bmx.
(A) Тепловая карта проявления генов воспаления в сердце.
(B) Графики, показывающие проявление воспалительных мРНК в сердце. Проявление Ccl2, Il-6, Irf1 и Tnf значительно снижается при лечении преднизолоном и ваморолоном.
(C) Тепловая карта дистрофин-таргетированных миРНК (DTM) и воспадительная миРНК в сердце. Розовыми звездочками обозначены DTM.
(D) Проявление miR-146a и miR-31 значительно снижается при лечении преднизолоном и ваморолоном.
(E) Проявление miR-497 значительно снижается при лечении ваморолоном, но не преднизолоном. Проявление miR-455-5p умеренно снижается при лечении ваморолоном.
(F) Тепловая карта экспрессии фибротических генов в сердце.
(G) Графики, отражающие проявление фибротических генов. Экспрессия Col1a1, Col3a1, Col6a1 и Tnc значительно снижается в сердце при лечении преднизолоном и ваморолоном n = 8 на группу. Данные проанализированы с помощью одностороннего дисперсионного анализа ANOVA с последующим тестом множественных сравнений Холма-Сидака. Данные*p ≤ 0,05, **p ≤ 0,01, ***p ≤ 0,001, ****p ≤ 0,0001.
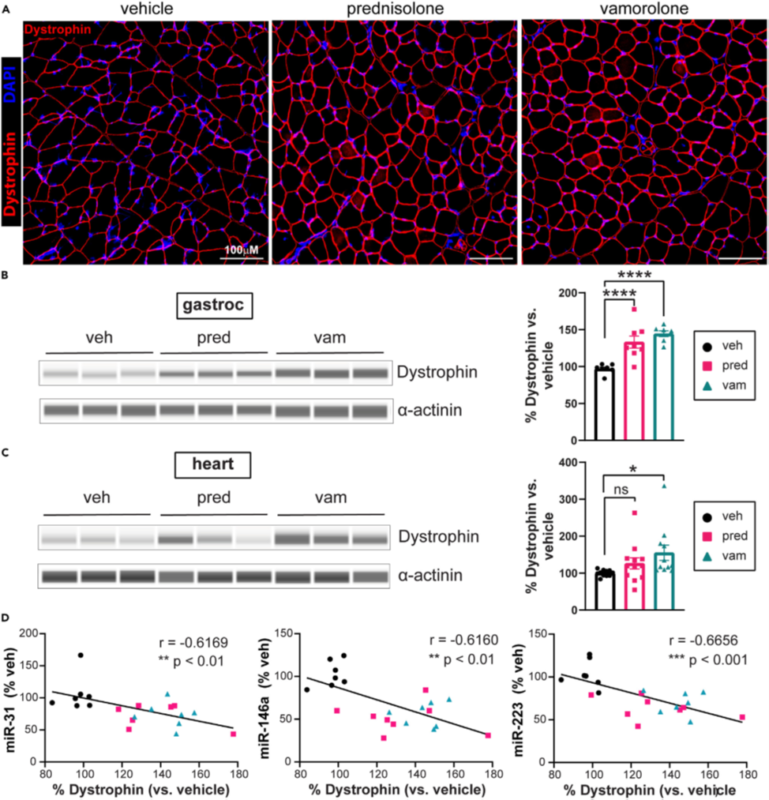
Рисунок 6. Ваморолон повышает уровень белка дистрофина в сердце и скелетных мышцах bmx.
Уровень белка дистрофина определяли в мышцах и сердце с помощью иммунофлуоресценции и количественно с помощью капиллярного электрофореза по Уэсу.
(A) Представленные изображения поперечных срезов икроножной мыщцы, иммуноокрашенные дистрофином. Шкала = 100 мм.
(B) Уровень белка дистрофина значительно повышается в икроножной мышце при использовании преднизолона и ваморолона. n = 8 на группу.
(C) Уровни белка дистрофина незначительно повышены в сердце при приеме преднизолона и значительно повышены при приеме ваморолона. n = 12 на группу.
(D) Уровни белка дистрофина в икроножной мышце обратно коррелируют с проявлением miR-31, miR-146a и miR-223. Данные проанализированы с помощью одностороннего дисперсионного анализа ANOVA с последующим тестом множественных сравнений Холма-Сидака. Данные представлены как среднее значение G S.E.M. ns p > 0,05, *p ≤ 0,05, ****p ≤ 0,0001. См.также рисунок S5.
ОБСУЖДЕНИЕ
Мы обнаружили, что ваморолон и преднизолон улучшают течение МДБ благодаря увеличению белка дистрофина за счет воздействия на воспалительные миРНК-пути.
Ваморолон — первый в своем классе диссоциированный стероид, который обеспечивает селективную противовоспалительную эффективность через GR и улучшенную безопасность по сравнению с преднизоном за счет снижения влияния на стероидные пути трансактивации. Влияние кортикостероидов на воспалительные миРНК показывает обратную корреляцию с уровнем белка дистрофина. Кроме того, ваморолон действует через эволюционно сохраненный MR-рецептор как антагонист, защищая сердце от дистрофической кардиомиопатии. Это свойство аналогично специфическому антагонисту эплеренону и действует прямо противоположно преднизолону, который является агонистом MR-рецепторов. В совокупности эти три свойства делают ваморолон привлекательным препаратом для лечения МДБ и позволяют в будущем разрабатывать лекарства для более широкой группы заболеваний мышечной, сердечной и иммуноопосредованной патологии.
До сих пор разработка терапевтических средств для лечения МДБ сдерживалась отсутствием подопытных животных. Хотя некоторые пациенты получают симптоматическое лечение кардиомиопатии с помощью ингибиторов ангиотензин-превращающего фермента, в настоящее время нет одобренных методов лечения для МДБ. Еженедельное лечение преднизоном в настоящее время проходит тестирование в комбинации пациентов с МДБ и поясно-конечностной мышечной дистрофией (ПКМД) (NCT04054375). Еще два препарата в настоящее время проходят клинические испытания, ориентированные на МДБ. Первый — EDG-5506, быстрый ингибитор миозина скелетных мышц (NCT05160415). Второй – ваморолон для ежедневного применения, в отношении которого мы приводим первые доказательства на живых организмах, на мышах с МДБ (NCT05166109). В отличие от небольшого количества интервенционных исследований для МДБ, в настоящее время проводится около 30 интервенционных исследований для МДД. В будущем разработка препаратов для лечения МДБ будет приобретать все большее значение, поскольку цель многих препаратов для лечения МДД является преобразование тяжелого генотипа МДД (дистрофин-ноль) в более мягкий фенотип, подобный МДБ (уменьшенный дистрофин) путем пропуска экзонов или генной терапии.
Наши доклинические данные также подтверждают эффективность преднизолона при лечении МДБ, для чего он может быть немедленно назначен. Мы обнаружили, что преднизолон улучшает мышечную силу и патологию у мышей с МДБ, снижает уровень миРНК, нацеленных на дистрофин, и повышает уровень дистрофина. Чтобы помочь справиться с побочными эффектами преднизолона, мы откладываем лечение мышей на 6 недель, а не на 2 недели, как в наших предыдущих исследованиях на более тяжелой модели МДД mdx. Это привело к меньшему проценту ингибирования роста преднизолоном у мышей bmx (2,6%) по сравнению с мышами mdx (6,3%). В настоящее время многим мальчикам с МДД назначают хронические глюкокортикоиды, начиная примерно с четырех-семи лет, что приводит к задержке развития, включая задержку роста, задержку скелетного созревания и задержку полового созревания. Эти побочные эффекты можно уменьшить или избежать у пациентов с МДБ по сравнению с пациентами с МДД, если отложить начало лечения на более поздний возраст, возможно до подросткового или пост пубертатного возраста. Однако некоторые негативные эффекты хронического приема глюкокортикоидов не ограничены по времени развития и все равно будут влиять на качество жизни. Альтернативной стратегией, помогающей уменьшить эти последствия, может быть применение интермиттирующих режимов или режимов дозирования по выходным, как, например, в текущем испытании еженедельного [приема] преднизолона у пациентов с МДБ и ПКМД (NCT04054375). Однако данные недавнего исследования МДД поддерживают использование ежедневных режимов приема кортикостероидов в отличие от интермиттирующих режимов, поэтому необходимы дальнейшие исследования таких альтернативных режимов.
Предыдущие исследования, проведенные в нашей лаборатории, показали, что DTM связывается с 30 UTR транскриптами дистрофина и снижают проявление белка репортерных конструкций (люциферазы) с 30 UTR дистрофина человека. Мы обнаружили, что 1) проявление DTM повышается под действием воспалительного NF-kB-сигналинга, 2) эти DTM повышаются при мышечных заболеваниях, таких как МДБ, МДД и миозит, и 3) ваморолон снижает проявление DTM у мышей mdx. Учитывая, что мыши mdx не вырабатывают белок дистрофин, мы не смогли изучить уровень белка дистрофина в предыдущих исследованиях. Здесь мы обнаружили, что ваморолон значительно снижает DTM и значительно повышает уровень белка дистрофина как в скелетных мышцах, так и в сердце. В соответствии с этим, предыдущие исследования показали повышенный уровень дистрофина у mdx-мышей, получавших антисмысловые олигонуклеотиды, пропуск экзонов, и преднизолон по сравнению с мышами mdx, получавшими только антисмысловые олигонуклеотиды и пропуск экзонов. В мышцах пациентов с МДБ лечение метилпреднизолоном увеличивало экспрессию дистрофина. Интересно, что в миофибриллах, полученных из индуцированных стволовых клеток дикого типа, после лечения преднизолоном, экспрессия дистрофина увеличилась, что говорит о том, что даже подавление базальных уровней ДМТ может быть достаточным для увеличения дистрофина. Мы обнаружили, что ваморолон значительно увеличивает содержание дистрофина в икроножной мышце и в сердце, но не в передней большеберцовой мышце при лечении ваморолоном. В совокупности эти данные позволяют предположить, что снижение miR-146a и miR-31 может быть ответственно за повышение уровня белка дистрофина. Будущие исследования, изучающие выбывание DTM или ингибиторов миРНК у мышей bmx или mdx, после терапии антисмысловыми олигонуклеотидами, пропуском экзонов. Для того чтобы установить прямую связь между уровнем белка дистрофина и проявлением DTM, необходимы дальнейшие исследования. Различное вовлечение мышц заметно благодаря miRs и увеличение уровня дистрофина может быть связано с различной тяжестью поражения мышц, наблюдаемой в исследованиях МРТ у человека, где изменения в передней большеберцовой мышце прогрессирует медленнее, чем в икроножной мышце.
В предыдущих исследованиях мы обнаружили, что у мышей mdx потеря дистрофина вызывает «второй удар», который делает сердца восприимчивыми к MR-повреждениям сердца, в то время как MR-агонисты не оказывают никакого влияния на мышей дикого типа с дистрофином полной длины. Здесь мы обнаружили, что преднизолон и ваморолон значительно снижают проявление воспалительных и фиброзных генов. Двойной агонист GR/MR, преднизолон, также не увеличивает сердечный фиброз или повреждение сердца у мышей bmx. Это позволяет предположить, что дистрофин Dex 45-47 может обеспечивать определенный уровень защиты сердца от повреждений и фиброза, опосредованных MR. Однако необходимы дальнейшие исследования с участием пожилых мышей, с сердцами подвергавшимися стрессу, альтернативными изоформами дистрофина или специфическими для MR лигандами, чтобы более полно оценить какие уровни защиты обеспечиваются.
Важным вопросом является следующее, является ли эффективность преднизолона при МДД результатом противовоспалительного действия в иммунных типах клеток или непосредственно в больных миофибриллах. Мы обнаружили, что преднизолон и ваморолон значительно снижают уровень воспалительных генов и миРНК в скелетных мышцах. Однако окрашивание скелетных мышц гематоксилином и эозином не выявило различий в инфильтрации иммунными клетками у обработанных препаратами мышей. Это позволяет предположить, что преднизолон и ваморолон действуют непосредственно на миофибриллы, снижая проявление воспалительных генов в мышечных волокнах и мионеврии. В соответствии с этим, преднизолон улучшает фенотип заболевания миофибрилл, полученные из индуцированных стволовых клеток дикого типа, с мутациями пациентов с МДД.
В то время как преднизолон и ваморолон смягчают патологию заболевания у мышей bmx, ваморолон позволяет избежать или уменьшить побочные эффекты преднизолона, которые негативно влияют на качество жизни. Предыдущие доклинические исследования показали, что ваморолон имеет меньше побочных эффектов по сравнению с преднизолоном, который вызывает потерю костной массы по данным микро-КТ-анализа, дисрегуляцию глюкозы по уровню сахара и инсулина в крови, иммуносупрессию по проточной цитометрии спленоцитов и замедление роста. И здесь, и в предыдущих исследованиях на мышах mdx мы обнаружили, что лечение преднизолоном значительно замедляет рост мышей, в то время как лечение ваморолоном влияет на рост гораздо меньше. Клинические данные показывают, что этот побочный эффект аналогичным образом устраняется ваморолоном и у людей. Недавно в рандомизированном двойном слепом плацебо-контролируемом параллельном клиническом исследовании ваморолона и преднизона у пациентов с МДД оказалось, что преднизон вызвал значительное снижение перцентиля роста пациентов. Группа, принимающая преднизон, значительно отличалась от двух групп лечения ваморолоном, ни в одной из которых не наблюдалось снижения перцентиля роста. Другие группы показали, что агонисты МР, такие как преднизолон, вызывают тревогу, в то время как антагонисты МР не вызывают тревоги. В данном случае мы также обнаружили, что преднизолон повышает тревожность у мышей bmx в лабиринте «плюс», в то время как ваморолон позволяет избежать этого побочного эффекта. Будущие исследования должны расширить эти результаты, полученные в ходе нашего десятинедельного испытания, и смоделировать долгосрочное клиническое применения стероидов у пациентов с МДБ, чтобы оценить их влияние на дополнительные меры безопасности и на результаты последующей стадии, такие как функция сердца. В настоящее время наши результаты в целом согласуются с различиями в профиле безопасности, наблюдаемыми в клинических испытаниях ваморолона и преднизона.
Хроническое применение глюкокортикоидов может вызывать увеличение веса, ожирение и кушингоидные черты у пациентов. Однако мы и другие исследователи постоянно обнаруживаем, что фармакологические глюкокортикоиды снижают массу тела у mdx мышей. Эти эффекты могут отражать дозозависимые различия между видами. Более высокие терапевтические дозы фармакологических (включая преднизолон, дефлазакорт, дексаметазон и триамцинолон) глюкокортикоидов у грызунов вызывают снижение массы тела, связанное с увеличением лептина. В противоположность этому, добавление низких доз физиологических глюкокортикоидов вызывает увеличение массы тела грызунов и аспекты жировой ткани или ожирения. Различия в содержании или реакции бурого жира у грызунов, который помогает защититься от метаболической дисфункции, могут способствовать видовым различиям. В исследованиях на грызунах такие факторы, как доза, содержание бурого или коричневого жира, комнатная температура, диета, пол, генотип и степень ожирения, как было установлено, влияют на воздействие глюкокортикоидов на вес, мышцы, метаболизм или ожирение. В дальнейшем необходимо проводить исследования, направленные на изучение ожирения и метаболизма в этиологии и лечении мышечной дистрофии. Поскольку эта область продолжает развиваться и заслуживает внимания, есть вероятность узнать больше о роли массы тела и ожирения в развитии дистрофии у пациентов или животных, а также на потенциал диссоциации метаболических побочных эффектов стероидов.
Полученные нами результаты могут иметь значение для других мышечных заболеваний, характеризующихся снижением уровня дистрофина в результате воспаления, таких как миозит. Носители МДД женского пола также показали снижение уровня дистрофина, не обоснованное пропорцией нормальных/ненормальных генов МДД в их мышцах, что также свидетельствует о снижении дистрофина, опосредованном воспалением, которое может быть реакцией на лечение ваморолоном. В дополнение к пациентам с МДБ, ваморолон обладает очевидным потенциалом повышения уровня дистрофина у пациентов с МДД, получающих лечение антисмысловыми пропускающими экзоны олигонуклеотидными препаратами (этеплирсен, голодирсен, вильтоларсен и касимерсен). Поскольку 3’UTR дистрофина консервативен между транскриптами МДБ и экзон-пропускающим DMD, они оба должны быть подвержены регуляции DTM и стероидами. В одном из исследований изучались уровни белка дистрофина у мышей mdx, после терапии 2-O-метилфосфоротиоатными антисмысловыми олигонуклеотидами. Исследование показало увеличение уровня дистрофина при совместном лечении преднизолоном по сравнению с мышами, получавшими только антисмысловой олигонуклеотид. Это позволяет предположить, что совместное лечение с ваморолоном может способствовать дальнейшему повышению уровня белка дистрофина у мышей mdx и пациентов с МДД без тяжелых побочных эффектов преднизолона. Будущие исследования на мышах mdx, получавших совместно ваморолон и антисмысловые олигонуклеотиды, пропуск экзонов, оправданы.
В заключение мы продемонстрировали, что ваморолон повышает двигательную функцию, улучшает гистопатологию мышц и увеличивает уровень белка дистрофина у мышей bmx, при этом он более безопасен по сравнению с традиционным кортикостероидом. Общие молекулярные патологии воспаления мышц и вторичного снижения уровня дистрофина наблюдаются и при других мышечных заболеваниях, таких как миозит, ПКМД и инфаркт миокарда. Наши данные свидетельствуют о том, что ваморолон может быть эффективен пациентам с МДБ и МДД, а также другим заболеваниям, поражающим мышцы или сердце.
Ограничения исследования
Ограничение данного исследования заключается в том, что здесь мы показали доклиническую эффективность лекарственных препаратов на мышах с bmx, но не проверяли клиническую эффективность на пациентах с МДБ. Клиническое испытание ваморолона было недавно завершено на пациентах с МДД (clinicaltrials.gov ID: NCT03439670). Ваморолон в настоящее время ожидает решения о разрешении регулирующих органов, а клиническое исследование ваморолона в настоящее время проводится у пациентов с МДБ (клиническое исследование № NCT05166109). Мы предполагаем, что миРНК, нацеленные на дистрофин, ответственны за снижение уровня белка дистрофина и что противовоспалительные стероиды повышают уровень белка дистрофина, снижая экспрессию этих миРНК. Полученные здесь данные демонстрируют обратную корреляцию этих уровней, чтобы полностью доказать причинно-следственную связь, необходимы дальнейшие исследования, чтобы расширить результаты этих и предыдущих исследований. Дальнейшие исследования должны быть направлены на уточнение этого механизма, определение степени его влияния на дистрофин при мышечных заболеваниях человека и выявление конкретных миРНК, которые могут быть терапевтически направлены на повышение уровня дистрофина.
ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ И ДАННЫЕ ОБ ИСПЫТУЕМЫХ
Животные
Все исследования на животных проводились в соответствии с Руководством NIH по уходу и использованию лабораторных животных. Все эксперименты проводились в соответствии с протоколами в рамках рекомендаций и с одобрения Комитета по уходу и использованию животных Детского национального медицинского центра. Животные содержались в контролируемом помещении для мышей с 12-часовым световым и 12-часовым темным фотопериодом, кормили вдоволь и ежедневно следили за состоянием здоровья. Мыши с bmx содержат эндогенную делецию экзонов 45-47 мышиного дистрофина, содержатся на фоне C57/BL6J и были ранее охарактеризованы. Использовались только самцы мышей, учитывая, что МДБ это Х-сцепленное заболевание, которое почти исключительно поражает самцов. Возраст мышей на момент начала лечения составлял 6 недель, лечение проводилось в течение 10 недель, а возраст мышей на момент завершения исследования составлял 16 недель.
Лечение препаратами
Мыши были случайным образом разделены на группы, сопоставимые по возрасту и весу (n = 12 мышей на группу) последующие эксперименты по фенотипированию проводились вслепую, без учета группы лечения. Мыши получали ежедневное пероральное лечение инертным средством (вишневый сироп), преднизолоном (5 мг/кг) или ваморолоном (20 мг/кг), начиная с 6-недельного возраста. В возрасте 16 недель мышей умерщвляли, проводили терминальные анализы и собирали ткани для последующих анализов. Функциональное тестирование и терминальные анализы были проведены на всех мышах. После умерщвления последующие молекулярные и гистологические эксперименты проводились на скелетных мышцах подгруппы из n = 8 мышей на группу. Для этого мышей отбирали случайным образом из каждой группы для последующей обработки и экспериментальных анализов. Такой размер выборки был признан достаточным для выявления различий в предыдущих молекулярных и гистологических исследованиях мышей с мышечной дистрофией mdx.
Тесты на двигательную функцию
Сила хвата передней и задней конечности оценивалась с помощью измерителя силы хвата (Columbus Instruments) ежедневно в течение 5 дней подряд в соответствии с протоколами Treat NMD (DMD_M.2.2.001), при этом данные интерпретировались как усредненные максимальные дневные значения. Тесты на подвешивание на проволоке двумя конечностями и на подвешивание на сетке четырьмя конечностями проводились в соответствии с протоколами Treat NMD (DMD_M.2.1.005). Для двулапого подвешивания на проволоке проволочная вешалка располагалась на высоте 35 см над клеткой с мягкой подстилкой. Мышей подвешивали, используя только передние конечности; однако им разрешалось раскачиваться и висеть на всех четырех конечностях, если они могли. Записывалось время подвешивания, при этом предел был 600 секунд. Для тестов с подвешиванием на четырех конечностях использовались те же параметры (высота 35 см, 600 секунд), но вместо этого мыши висели вверх ногами в коробке ручной работы, покрытой проволочной сеткой (сетка 1×1 см).
Приподнятый «плюс» лабиринт
В возрасте 12 недель мышей помещали на стык открытой и закрытой ветвей лабиринта, мордой к открытой ветви, противоположной той, где находится экспериментатор. Мышам позволяли исследовать приподнятый «плюс» лабиринт в течение 5 минут, в то время как верхняя камера фиксировала движение мыши. Была произведена количественная оценка проведенного времени в открытом и закрытом лабиринтах.
Иммунофлуоресценция
Мышцы устанавливали на пробках, замороженных в изопентане, охлажденном жидким азотом, и секционировали (8 мм) на предметных стеклах. Для большинства экспериментов по иммунофлуоресценции срезы мышц фиксировали в холодном ацетоне в течение 10 минут. Для иммунофлуоресценции анти-IgM срезы мышц фиксировали 4%-ным параформальдегидом в течение 10 минут при комнатной температуре. Срезы промывали 1X PBST (0,1% Tween 20), блокировали в течение 1 часа (1X PBST с 0,1% Triton X-100, 1% BSA, 10% козьей сыворотки и 10% лошадиной сыворотки), промывали 3 раза, затем подвергали воздействию первичные антитела на ночь при 4C: антидистрофин 1:150 (Abcam, #ab154168), антиламинин-2 1:100 (Sigma-Aldrich, кат. #L0663) и анти-мышиный IgM-FITC 1:100 (Sigma-Aldrich, #F9259). Вторичные антитела включали: козье анти-кроличье 568 1:400 (ThermoFisher, #A-11036), ослиное анти-крысиное 488 1:400 (ThermoFisher, #A-21208) и козье антикрысиное антитело 647 1:400 (ThermoFisher, #A-21247). Покровные стекла монтировали с помощью Prolong Gold Mounting Medium с DAPI (ThermoFisher, #P36931). Изображения на предметных стеклах получали с помощью сканирующего микроскопа Olympus VS-120 при 20-кратном увеличении.
Гистологическое окрашивание
Для анализа некроза и воспаления использовали гематоксилин и эозин. Вкратце, срезы тканей окрашивали гематоксилином в течение 10 минут, а избыток красителя удаляли проточной водой до тех пор, пока ядра не окрашивались в синий цвет. Срезы инкубировали в 70 % этаноле в течение 3 минут, а затем окрашивали эозином в течение 3 минут. Участки тканей обезвоживали этанолом и очищали ксилолом. Покровные пластины монтировали с помощью перманента. Для анализа фиброза проводили быстрое окрашивание Sirius red fast green. Вкратце, участки ткани фиксировали в 4% параформальдегиде в течение 10 минут с последующим промыванием в дистиллированной воде. Участки инкубировали с раствором красителя (Chondrex #9046) в течение 30 минут в увлажненной камере при комнатной температуре. Участки тканей промывали дистиллированной водой до тех пор, пока вода не становилась прозрачной, а затем последовательно обезвоживали в 70, 95 и 100% этаноле. Срезы очищали ксилолом и устанавливали на покровные пластины с помощью перманента. Все снимки со всех слайдов получали с помощью сканирующего микроскопа Olympus VS-120 при 20-кратном увеличении.
Гистологический анализ мышц
Площадь поперечного сечения (ППС) и минимальный диаметр Ферета определяли с помощью макроса MuscleJ для программы Fiji.62 Коэффициенты дисперсии для ППС и минимального диаметра Ферета рассчитывали путем деления среднего отклонения на среднее значение и умножения на 1000. Центральнонуклеированные волокна подсчитывали вручную в программе ImageJ. Процент IgM-позитивных миоволокон рассчитывали для количественной оценки повреждения мышц. Для анализа фиброза использовали плагин Colour Deconvolution 2 для ImageJ, чтобы разделить красители Sirius red fast green. Слой, содержащий окрашивание красным Сириусом, выделялся пороговым значением, участок мышцы контурировался и определяли процент площади, окрашенной красным Сириусом. Окрашивание гематоксилином и эозином проводилось для оценки некроза и воспаления. Для выделения областей некроза и воспаления использовали программу ImageJ.
Выделение белков и Wes.
Мышцы препарировали и замораживали в изопентане, охлажденном жидким азотом. 8-миллиметровые срезы лизировали в высоком SDS-буфере, содержащем 0,02% ЭДТА (pH 8,0), 0,075% Трис-HCl (pH 6,8) и ингибиторы протеаз и фосфатаз. Капиллярный Вестерн-иммуноанализ (Wes) проводили в соответствии с инструкциями производителя с использованием модулей разделения 66-440 кДа (ProteinSimple). В каждый капилляр загружали 0,2 мг/мл белка для анализа с антителами к дистрофину (Abcam #ab15277, разведение 1:15) или альфа-актинину (Abcam #ab68167, разведение 1:100) и вторичными антирабическими антителами (ProteinSimple #042-206). Для количественной оценки данных хемилюминесценции использовали программное обеспечение Compass for SW, данные представлены в % bmx + инертное средство.
Выделение РНК и анализ методом qPCR
qRT-PCR миРНК и мРНК проводили, как сообщалось ранее, подробности и идентификаторы анализов приведены в Вспомогательных материалах (табл. S1). 50-100 срезов (толщиной 8 мм) мышц мыши гомогенизировали в 1 мл Trizol (Life Technologies) с помощью гомогенизатора TissueRupter II (Qiagen). РНК преобразовывали в кДНК с помощью набора для обратной транскрипции кДНК High Capacity (Thermo Fisher #4368813).
Количественная оценка и статический анализ
Статистический анализ проводили с помощью программы GraphPad Prism v.9.0.0 (GraphPad Software, Inc.). Распределение точек данных оценивали с помощью теста нормальности Шапиро-Уилка, а однородность вариаций — с помощью теста Брауна-Форсайта. Выбросы определяли с помощью теста ROUT, где Q = 5 %. Данные анализировали с помощью одностороннего дисперсионного анализа (ANOVA; для сравнений с одной независимой переменной и >2 групп). Post hoc-анализ проводили с помощью теста Хольма-Сидака, сравнивая инертное средство против преднизолона и инертное средство против ваморолона. Статистически значимым считалось значение p % 0,05. На всех графиках данные представлены как среднее значение G SEM.
